المستويات الهيكلية والوظيفية لتنظيم المواد الوراثية. تنظيم المواد الوراثية في بدائيات النواة وحقيقيات النوى
التنظيم الهيكلي والوظيفي للمواد الوراثية
4.2 خصائص الدنا كمادة وراثية وتنوع
4.2.3 التغييرات في متواليات نوكليوتيدات الدنا.
4.2.4 الوحدات الأولية لتقلبات المادة الجينية. موتون. ريكون
4.2.6 الآليات التي تقلل التأثير الضار للطفرات الجينية
4.3 استخدام المعلومات الجينية في عمليات الحياة
4.3.2 سمات التنظيم والتعبير عن المعلومات الجينية في الكائنات الأولية وحقيقيات النوى
1. الوراثة والتنوع هي الخصائص الأساسية للعيش
تتميز الحياة كظاهرة خاصة بمدة الوجود في الزمن (نشأت على الأرض منذ أكثر من 3.5 مليار سنة) ، والتي يتم ضمانها من خلال استمرارية أجيال من النظم الحية. هناك تغيير في أجيال الخلايا في الجسم ، وتغير في أجيال الكائنات الحية في السكان ، وتغيير في الأنواع في نظام التكاثر الحيوي ، وتغيير في التكوينات الحيوية التي تشكل المحيط الحيوي. تكمن قدرة الأنظمة الحية على التكاثر الذاتي في أساس الوجود المستمر للحياة في الوقت المناسب. إن الحفاظ على الحياة في الظروف المتغيرة أمر ممكن بسبب تطور الأشكال الحية ، والتي تحدث خلالها تغييرات توفر التكيف مع بيئة جديدة. يعود استمرار الوجود والتطور التاريخي للطبيعة الحية إلى خاصيتين أساسيتين للحياة: الوراثة والتنوع.
في الدورات التدريبية ، تعتبر خصائص الوراثة والتنوع تقليديًا فيما يتعلق بالخلية والكائن الحي. في الواقع ، تظهر أيضًا على مستويات فوق العضوية. على المستويات الخلوية والعضوية (الوراثية) لتنظيم الكائنات الحية ، تُفهم الوراثة على أنها خاصية للخلايا أو الكائنات الحية في عملية التكاثر الذاتي لنقل القدرة إلى جيل جديد على نوع معين من التمثيل الغذائي والتطور الفردي ، يتم خلالها تكوين سمات وخصائص مشتركة لنوع خلية معين ونوع من الكائنات الحية ، بالإضافة إلى بعض الخصائص الفردية للآباء. على مستوى الأنواع السكانية في تنظيم الحياة ، تتجلى الوراثة في الحفاظ على نسبة ثابتة من الأشكال الجينية المختلفة في عدد من أجيال الكائنات الحية لمجموعة معينة (الأنواع). على مستوى التكاثر الحيوي ، يتم ضمان استمرار وجود التكاثر الحيوي من خلال الحفاظ على نسب معينة من أنواع الكائنات الحية التي تشكل هذا التكاثر الحيوي.
في سياق ظهور الحياة على الأرض وتطورها ، لعبت الوراثة دورًا حاسمًا ، حيث عززت المقتنيات التطورية المفيدة بيولوجيًا في عدد من الأجيال ، مما يضمن بعض النزعة المحافظة في تنظيم النظم الحية. الوراثة هي أحد العوامل الرئيسية للتطور.
سيكون استمرار وجود الطبيعة الحية في الوقت المناسب على خلفية الظروف المتغيرة أمرًا مستحيلًا إذا لم يكن لدى الأنظمة الحية القدرة على اكتساب والحفاظ على تغييرات معينة مفيدة في الظروف البيئية الجديدة. تسمى خاصية الأنظمة الحية لاكتساب التغييرات والوجود في المتغيرات المختلفة التباين.
في الخلايا والكائنات الحية من نفس النوع ، يتجلى التباين ، الذي يؤثر على نموهم الفردي ، في ظهور الاختلافات بينهم. على مستوى الأنواع السكانية في تنظيم الحياة ، تتجلى هذه الخاصية في وجود اختلافات جينية بين المجموعات الفردية للأنواع ، والتي تكمن وراء تكوين أنواع جديدة. يقدم ظهور أنواع جديدة تغييرات في العلاقات بين الأنواع في التكاثر الحيوي. بمعنى ما ، يعكس التباين ديناميكية تنظيم النظم الحية ، إلى جانب الوراثة ، هو العامل الرئيسي في التطور. على الرغم من حقيقة أنه وفقًا لنتائجهم ، فإن الوراثة والتنوع متعدد الاتجاهات ، في الطبيعة الحية ، تشكل هاتان الخاصيتان الأساسيتان وحدة لا يمكن فصلها ، والتي تضمن في نفس الوقت الحفاظ على الصفات المفيدة بيولوجيًا الموجودة في عملية التطور وظهور خصائص جديدة تجعل الحياة ممكنة في ظروف مختلفة.
2. تاريخ تكوين الأفكار حول تنظيم الركيزة المادية للوراثة والتنوع
الوراثة والتنوع ، كأهم خصائص أي نظام حي ، يتم ضمانهما من خلال عمل ركيزة مادية خاصة. في سياق التطور التاريخي للعلوم البيولوجية ، تتوسع الأفكار المتعلقة بخصائصها وتنظيمها وطبيعتها الكيميائية باستمرار وتصبح أكثر تعقيدًا.
في الستينيات. القرن ال 19 قدم مؤسس علم الوراثة (علم الوراثة والتنوع) جي مندل (1865) الافتراضات الأولى حول تنظيم المادة الوراثية. بناءً على نتائج تجاربه على البازلاء ، توصل إلى استنتاج مفاده أن المادة الوراثية منفصلة ، أي تتمثل في الميول الوراثية الفردية المسؤولة عن تطور خصائص معينة للكائنات الحية. وفقًا لميندل ، في المادة الوراثية لكائنات التكاثر الجنسي ، يتم توفير تطوير سمة واحدة من خلال زوج من الميول الأليلية التي تأتي مع خلايا جرثومية من كلا الوالدين. أثناء تكوين الأمشاج ، يدخل واحد فقط من زوج من الميول الأليلية في كل منهما ، وبالتالي فإن الأمشاج تكون دائمًا "نقية". في عام 1909 م. دعا يوهانسن جينات مندل "الميول الوراثية".
الثمانينيات القرن ال 19 تميزت بإنجازات مهمة في مجال علم الخلايا: تم وصف الانقسام والانقسام الاختزالي - تقسيم الخلايا الجسدية والجراثيم ، على التوالي ، حيث يتم توزيع الهياكل النووية - الكروموسومات - بانتظام بين الخلايا الوليدة (V. Voldeyer ، 1888).
جعلت البيانات المتعلقة بطبيعة توزيع الكروموسومات في عملية انقسام الخلية من الممكن في بداية القرن العشرين. خلص Boveri (1902-1907) و W. Setgon (1902-1903) إلى أن استمرارية الخصائص في عدد من الأجيال من الخلايا والكائنات الحية تحددها استمرارية كروموسوماتها. بدأ اعتبار الكروموسومات كناقلات مادية للبرنامج الوراثي.
تم إجراء مزيد من التطوير لنظرية الكروموسوم للوراثة ، والتي تجمع بين الأفكار حول الميول الوراثية والكروموسومات ، في بداية القرن العشرين. ت. مورجان ومعاونيه. في التجارب التي أجريت على ذبابة الفاكهة ، تم تأكيد الافتراض السابق حول دور الكروموسومات في ضمان الوراثة. لقد ثبت أن الجينات توجد في الكروموسومات الموجودة فيها بترتيب خطي. تشكل جينات كل كروموسوم مجموعة ربط ، يتم تحديد عددها من خلال عدد الكروموسومات في الخلايا الجرثومية. يتم توريث جينات مجموعة الربط نفسها ، كقاعدة عامة ، معًا. ومع ذلك ، في عدد من الحالات ، يحدث إعادة التركيب بسبب العبور ، والذي يعتمد تواتره على المسافة بين الجينات.
وهكذا ، فإن أحد أهم مبادئ علم الوراثة ، وهو وحدة التكتم واستمرارية المادة الوراثية ، انعكست في نظرية الكروموسوم.
وتجدر الإشارة إلى أنه في بداية القرن العشرين أيضًا. تم اكتشاف الحقائق التي أثبتت وجود مادة وراثية خارج الصبغية في الخلايا موجودة في هياكل مختلفة من السيتوبلازم وتحديد وراثة حشوية خاصة (K. Korrens ، 1908).
في نفس الوقت تقريبًا ، وضع X. de Vries (1901) أسس نظرية التغير الطفري المرتبط بالتغيرات المفاجئة في الميول الوراثية أو الكروموسومات ، مما يؤدي إلى تغييرات في علامات معينة للكائن الحي. في السنوات اللاحقة ، تم اكتشاف التأثير المطفر على الكروموسومات وجينات الأشعة السينية والإشعاع وبعض المواد الكيميائية والعوامل البيولوجية.
نتيجة لهذه الدراسات ، أصبح من الواضح أن الوراثة والتنوع يرجعان إلى عمل نفس المادة الأساسية.
في العقود الأولى من القرن العشرين. تم الحصول على البيانات التي تدل على اعتماد حالة السمات على طبيعة تفاعل الجينات ، والتي تجاوزت علاقات الهيمنة والتراجع التي وصفها مندل. من هنا جاءت فكرة الجهاز الجيني كنظام لتفاعل الجينات - النمط الجيني ، الذي يتركز في مجموعة الكروموسوم - النمط النووي.
كشفت دراسة التركيب الكيميائي للكروموسومات عن نوعين رئيسيين من المركبات التي تشكل هذه الهياكل - البروتينات والأحماض النووية. في النصف الأول من القرن العشرين. قام الباحثون بحل مسألة الطبيعة الكيميائية لطبقة الوراثة والتنوع. في البداية ، تم تقديم اقتراحات لصالح البروتينات. في عام 1928 ، قام ف. أجرى جريفيث تجربة على المكورات الرئوية ، حيث لوحظ تغيير (تحول) في بعض الخصائص الوراثية لسلالة بكتيرية واحدة تحت تأثير مادة تم الحصول عليها من خلايا ميتة من سلالة أخرى. تم تأسيس الطبيعة الكيميائية للمادة التي تحول الخصائص الوراثية للبكتيريا فقط في عام 1944. O. أفيري ، الذي أثبت أنه ينتمي إلى الأحماض النووية (DNA).
الأدلة الأخرى على تورط الحمض النووي في ضمان الوراثة والتنوع هي:
1) ثبات محتوى الحمض النووي في جميع أنواع الخلايا الجسدية في الجسم ؛
2) تطابق محتوى الحمض النووي مع تعدد الخلايا (في الخلايا الجسدية يكون ضعف ما هو عليه في الخلايا الجرثومية ، وفي الخلايا متعددة الصبغيات يتوافق مع عدد مجموعات الكروموسومات) ؛
3) ظاهرة إعادة التركيب الجيني للبكتيريا أثناء اقترانها ، حيث يخترق جزء من الحمض النووي من خلية إلى أخرى ويتغير في خصائص الأخيرة ؛
4) تغيير الخصائص الوراثية للخلايا البكتيرية عن طريق نقل الحمض النووي من سلالة إلى أخرى بمساعدة عاثية DNA - ظاهرة التنبيغ ؛
5) النشاط المعدي للحمض النووي المعزول للفيروسات.
كانت إحدى النتائج المهمة للدراسة الهادفة للأحماض النووية هي إنشاء J. Watson و F. Crick (1953) لنموذج مكاني لجزيء DNA.
في النصف الثاني من القرن العشرين. تهدف جهود العلماء إلى دراسة خصائص الأحماض النووية التي تشكل أساس وظائفها الجينية ، وطرق تسجيل وقراءة المعلومات الوراثية ، وطبيعة وهيكل الكود الجيني ، وآليات تنظيم نشاط الجينات في عملية تكوين الصفات الفردية والنمط الظاهري ككل. في الستينيات. قامت أعمال M. Nirenberg و S. Ochoa و X. Korana وآخرون بفك تشفير كامل للشفرة الجينية ، وإنشاء مراسلات ثلاثية النوكليوتيدات في جزيء الحمض النووي مع بعض الأحماض الأمينية. في السبعينيات. بدأ تطوير أساليب الهندسة الوراثية بنشاط ، مما يجعل من الممكن تغيير الخصائص الوراثية للكائنات الحية عن قصد.
بحلول نهاية القرن العشرين ، وبفضل التقنيات الوراثية الجزيئية الجديدة ، أصبح من الممكن تحديد تسلسل النيوكليوتيدات في جزيئات الحمض النووي لجينوم الكائنات الحية المختلفة (قراءة نصوص الحمض النووي). تمت قراءة نصوص الحمض النووي للجينوم البشري ، التي يمثلها إجمالي 3 مليارات زوج قاعدي ، بحلول عام 2001. يُطلق على الاتجاه العلمي والعملي للبيولوجيا الجزيئية ، والذي يهدف إلى تحديد تسلسل النوكليوتيدات لجزيئات الحمض النووي ، علم الجينوم.
3. الخصائص العامة للمادة الوراثية ومستويات تنظيم الجهاز الوراثي
بناءً على التعريفات المذكورة أعلاه للوراثة والتنوع ، يمكننا أن نفترض المتطلبات التي يجب أن تلبيها المادة الأساسية لهاتين الخاصيتين للحياة.
أولاً ، يجب أن تكون المادة الجينية قادرة على التكاثر الذاتي من أجل في عملية الاستنساخ ، نقل المعلومات الوراثية ، والتي على أساسها سيتم تكوين جيل جديد. ثانيًا ، من أجل ضمان استقرار الخصائص في عدد من الأجيال ، يجب أن تحافظ المادة الوراثية على ثبات تنظيمها. ثالثًا ، يجب أن تكون مادة الوراثة والتنوع قادرة على اكتساب التغييرات وإعادة إنتاجها ، مما يجعل من الممكن التطور التاريخي للمادة الحية في ظل الظروف المتغيرة. فقط إذا استوفت المتطلبات المحددة ، يمكن أن تضمن الركيزة المادية للوراثة والتنوع مدة واستمرارية وجود الطبيعة الحية وتطورها.
تتيح الأفكار الحديثة حول طبيعة الجهاز الجيني التمييز بين ثلاثة مستويات من تنظيمه: الجين والكروموسومات والجينوم. في كل منها ، تتجلى الخصائص الرئيسية لمادة الوراثة والتنوع وأنماط معينة من انتقالها وعملها.
4. المستوى الجيني لتنظيم الجهاز الجيني
الوحدة الوظيفية الأولية للجهاز الوراثي ، والتي تحدد إمكانية تطوير سمة معينة لخلية أو كائن حي من نوع معين ، هي جين (إيداع وراثي ، وفقًا لـ G.Mendel). عن طريق نقل الجينات في سلسلة أجيال من الخلايا أو الكائنات الحية ، يتم تحقيق استمرارية المواد - وراثة الصفات الأبوية من قبل الأحفاد.
تُفهم العلامة على أنها وحدة شكلية ، وفسيولوجية ، وكيميائية حيوية ، ومناعة ، وسريرية وأي نوع آخر من التمييز للكائنات (الخلايا) ، أي صفة أو خاصية منفصلة تختلف من خلالها عن بعضها البعض.
تنتمي معظم سمات الكائنات الحية أو الخلايا المذكورة أعلاه إلى فئة السمات المعقدة ، والتي يتطلب تكوينها تخليق العديد من المواد ، وبشكل أساسي بروتينات ذات خصائص محددة - الإنزيمات والبروتينات المناعية والبروتينات الهيكلية والمقلصة والبروتينات الأخرى. يتم تحديد خصائص جزيء البروتين من خلال تسلسل الأحماض الأمينية لسلسلة البولي ببتيد الخاصة به ، والتي يتم تحديدها مباشرة من خلال تسلسل النيوكليوتيدات في الحمض النووي للجين المقابل وهي ميزة أولية أو بسيطة.
يتم تحديد الخصائص الرئيسية للجين كوحدة وظيفية للجهاز الوراثي من خلال تنظيمه الكيميائي ،
4.1 التنظيم الكيميائي للجين
أثبتت الدراسات التي تهدف إلى توضيح الطبيعة الكيميائية للمادة الوراثية بشكل قاطع أن الركيزة المادية للوراثة والتنوع هي أحماض نووية ، اكتشفها F.Miescher (1868) في نوى الخلايا الصديدية. الأحماض النووية هي جزيئات كبيرة ، أي لها وزن جزيئي مرتفع. هذه عبارة عن بوليمرات تتكون من مونومرات - نيوكليوتيدات ، بما في ذلك ثلاثة مكونات: سكر (بنتوز) ، فوسفات وقاعدة نيتروجينية (بورين أو بيريميدين). يتم ربط قاعدة نيتروجينية (أدينين ، جوانين ، سيتوزين ، ثايمين أو يوراسيل) بأول ذرة كربون في جزيء البنتوز C-1 ، ويتم ربط الفوسفات بذرة الكربون الخامسة C-5 "باستخدام رابطة إيثر ؛ تحتوي ذرة الكربون الثالثة C-3 دائمًا على مجموعة هيدروكسيل - OH (الشكل 1).
يحدث اتصال النيوكليوتيدات بجزيء الحمض النووي الكبير عن طريق تفاعل فوسفات أحد النوكليوتيدات مع هيدروكسيل آخر بحيث يتم إنشاء رابطة فسفودايستر بينهما (الشكل 2). والنتيجة هي سلسلة من عديد النوكليوتيدات. يتكون العمود الفقري للسلسلة من تناوب جزيئات الفوسفات والسكر. ترتبط إحدى القواعد النيتروجينية المذكورة أعلاه بجزيئات البنتوز في موضع C-1 "(الشكل 3).
رسم بياني 1. رسم تخطيطي لهيكل النيوكليوتيدات
انظر النص للشرح ؛ يتم الاحتفاظ بتسميات مكونات النوكليوتيدات المستخدمة في هذا الشكل في جميع مخططات الحمض النووي اللاحقة
يتم تنفيذ تجميع سلسلة البولي نيوكليوتيد بمشاركة إنزيم البوليميراز ، والذي يضمن ارتباط مجموعة الفوسفات من النيوكليوتيد التالي بمجموعة الهيدروكسيل في الموضع 3 "من النيوكليوتيد السابق (الشكل 3.3). خصوصية ملحوظة لعمل الإنزيم المسمى ، فإن نمو سلسلة عديد النوكليوتيد يحدث فقط في طرف واحد: حيث يوجد الهيدروكسيل الحر في الموضع 3 ". تحمل بداية السلسلة دائمًا مجموعة فوسفات في الموضع 5 ". وهذا يسمح لك بتحديد نهايتي 5" و 3 "فيها.
من بين الأحماض النووية ، هناك نوعان من المركبات المميزة: أحماض ديوكسي ريبونوكلييك (DNA) وأحماض ريبونوكلييك (RNA). وجدت دراسة تركيبة الناقلات الرئيسية للمواد الوراثية - الكروموسومات - أن أكثر مكوناتها استقرارًا كيميائيًا هو الحمض النووي ، وهو ركيزة الوراثة والتنوع.
4.1.1 هيكل الحمض النووي. نموذج بواسطة J. Watson و F. Crick
يتكون الحمض النووي من نوكليوتيدات ، والتي تشمل السكر - الديوكسيريبوز والفوسفات وأحد القواعد النيتروجينية - البيورين (الأدينين أو الجوانين) أو بيريميدين (الثايمين أو السيتوزين). تتمثل إحدى سمات التنظيم الهيكلي للحمض النووي في أن جزيئاته تشتمل على سلسلتين عديد النوكليوتيد مترابطتين بطريقة معينة. وفقًا لنموذج الحمض النووي ثلاثي الأبعاد المقترح في عام 1953 من قبل الفيزيائي الأمريكي ج. الأدينين من سلسلة واحدة متصل برابطتين هيدروجينيتين مع ثايمين لسلسلة أخرى ، وتتكون ثلاث روابط هيدروجينية بين الجوانين والسيتوزين من سلاسل مختلفة. يوفر هذا الاتصال للقواعد النيتروجينية اتصالًا قويًا بين السلسلتين ويحافظ على مسافة متساوية بينهما طوال الوقت.

الشكل 4. رسم تخطيطي لبنية جزيء الحمض النووي. تشير الأسهم إلى عدم موازاة الأهداف.
ميزة أخرى هامة للارتباط بين سلسلتين عديد النوكليوتيد في جزيء DNA هو مضادهما المتوازي: يتم توصيل الطرف 5 "من سلسلة واحدة بالطرف 3" للطرف الآخر ، والعكس صحيح (الشكل 4).
أظهرت بيانات حيود الأشعة السينية أن جزيء الحمض النووي المكون من خيطين يشكلان حلزونيًا ملتويًا حول محوره. قطر الحلزون 2 نانومتر ، طول الملعب 3.4 نانومتر. يحتوي كل دور على 10 أزواج من النيوكليوتيدات.
في أغلب الأحيان ، تكون اللولب المزدوج يمينًا - عند التحرك لأعلى على طول محور اللولب ، تتحول السلاسل إلى اليمين. معظم جزيئات الحمض النووي في المحلول موجودة في شكل B الأيمن (B-DNA). ومع ذلك ، هناك أيضًا أشكال أعسر (Z-DNA). لم يتم تحديد مقدار هذا الحمض النووي الموجود في الخلايا وما هي أهميته البيولوجية (الشكل 3.5).

الشكل 5. النماذج المكانية لشكل Z الأيسر (I) والشكل الأيمن B (II) من الحمض النووي
وهكذا ، في التنظيم الهيكلي لجزيء الحمض النووي ، يمكن للمرء أن يميز الهيكل الأساسي - سلسلة عديد النوكليوتيد ، والبنية الثانوية - سلسلتان متعدد النوكليوتيد مكملان ومضادان للتوازي متصلان بواسطة روابط هيدروجينية ، والبنية الثلاثية - حلزون ثلاثي الأبعاد مع ما سبق الخصائص المكانية.
4.1.2 طريقة لتسجيل المعلومات الجينية في جزيء DNA. الكود البيولوجي وخصائصه
في المقام الأول ، يتم تحديد كل تنوع الحياة من خلال تنوع جزيئات البروتين التي تؤدي وظائف بيولوجية مختلفة في الخلايا. يتم تحديد بنية البروتينات من خلال مجموعة وترتيب الأحماض الأمينية في سلاسل الببتيد الخاصة بهم. إنه تسلسل الأحماض الأمينية في الببتيدات المشفرة في جزيئات الحمض النووي باستخدام رمز بيولوجي (جيني). منعت البدائية النسبية لبنية الحمض النووي ، التي تمثل تناوب أربعة نيوكليوتيدات مختلفة فقط ، الباحثين لفترة طويلة من اعتبار هذا المركب ركيزة مادية للوراثة والتنوع ، حيث يجب تشفير المعلومات المتنوعة للغاية.
في عام 1954 ، قام ج. اقترح جامو أن ترميز المعلومات في جزيئات الحمض النووي يجب أن يتم عن طريق توليفات من عدة نيوكليوتيدات. في مجموعة متنوعة من البروتينات الموجودة في الطبيعة ، تم العثور على حوالي 20 نوعًا من الأحماض الأمينية المختلفة. لتشفير مثل هذا العدد ، يمكن أن يوفر رمز ثلاثي فقط عددًا كافيًا من مجموعات النيوكليوتيدات ، حيث يتم تشفير كل حمض أميني بواسطة ثلاثة نيوكليوتيدات متجاورة. في هذه الحالة ، 4 3 = 64 ثلاثة توائم تتكون من أربعة نيوكليوتيدات. من شأن الكود الذي يتكون من نيوكليوتيدات أن يجعل من الممكن تشفير 4 2 = 16 حمضًا أمينيًا مختلفًا.
تم تنفيذ فك الشفرة الجينية بالكامل في الستينيات. قرننا. من الـ 64 توائم المحتملة للحمض النووي ، هناك 61 من الأحماض الأمينية المختلفة. الثلاثة المتبقية تسمى بلا معنى ، أو "ثلاثة توائم بلا معنى". لا تقوم بتشفير الأحماض الأمينية وتعمل كعلامات ترقيم عند قراءة المعلومات الوراثية. وتشمل هذه ATT و ACT و ATC.
يتم لفت الانتباه إلى التكرار الواضح للشفرة ، والذي يتجلى في حقيقة أن العديد من الأحماض الأمينية يتم تشفيرها بواسطة عدة توائم (الشكل 6). هذه الخاصية للشفرة الثلاثية ، التي تسمى الانحطاط ، مهمة للغاية ، لأن حدوث تغيرات في بنية جزيء الحمض النووي بنوع استبدال نيوكليوتيد واحد في سلسلة عديد النوكليوتيدات قد لا يغير معنى الثلاثي. يشفر المزيج الجديد الناتج من ثلاثة نيوكليوتيدات نفس الحمض الأميني.
في عملية دراسة خصائص الشفرة الجينية ، تم اكتشاف خصوصيتها. يمكن لكل ثلاثة توائم أن يرمز لحمض أميني محدد واحد فقط. حقيقة مثيرة للاهتمام هي التطابق الكامل للرمز في أنواع مختلفة من الكائنات الحية. تشهد هذه الشمولية للشفرة الجينية على وحدة أصل كل تنوع الأشكال الحية على الأرض في عملية التطور البيولوجي. تم العثور على اختلافات طفيفة في الشفرة الجينية في الحمض النووي للميتوكوندريا لبعض الأنواع. هذا لا يتعارض بشكل عام مع البيان حول عالمية الكود ، لكنه يشهد لصالح اختلاف معين في تطورها في المراحل الأولى من وجود الحياة. أظهر فك شفرة الشفرة في الحمض النووي للميتوكوندريا للأنواع المختلفة أنه في جميع الحالات ، يمتلك الحمض النووي للميتوكوندريا ميزة مشتركة: تتم قراءة ثلاثي ACT على أنه ACC ، وبالتالي فإنه يتحول من ثلاثي هراء إلى تشفير الأحماض الأمينية التربتوفان.

الشكل 6. الأحماض الأمينية وثلاثة توائم الحمض النووي ترميزها
الميزات الأخرى خاصة بأنواع مختلفة من الكائنات الحية. في الخميرة ، يشفر GAT الثلاثي ، وربما عائلة GA بأكملها ، ثريونين بدلاً من ليسين الأحماض الأمينية. في الثدييات ، يكون لـ TAG triplet نفس المعنى مثل TAC ورموز للأحماض الأمينية ميثيونين بدلاً من isoleucine. ثلاثة توائم من TCH و TCC في الحمض النووي للميتوكوندريا لبعض الأنواع لا تشفر الأحماض الأمينية ، كونها ثلاثية هراء. إلى جانب التثليث والانحلال والنوعية والعالمية ، فإن أهم خصائص الشفرة الجينية هي استمراريتها وعدم تداخلها مع الكودونات أثناء القراءة. هذا يعني أن تسلسل النوكليوتيدات يُقرأ ثلاث مرات بثلاثة توائم دون فجوات ، بينما لا يتداخل الثلاثة المتجاورون مع بعضهم البعض ، أي كل نوكليوتيد فردي هو جزء من ثلاثة توائم واحد فقط لإطار قراءة معين (الشكل 3.7). والدليل على عدم تداخل الشفرة الجينية هو استبدال حمض أميني واحد فقط في الببتيد عند استبدال نوكليوتيد واحد في الحمض النووي. في حالة تضمين نيوكليوتيد في عدة توائم ثلاثية متداخلة ، فإن استبداله يستلزم استبدال 2-3 من الأحماض الأمينية في سلسلة الببتيد.
الشكل 7. استمرارية الكود الجيني وعدم قابليته للجدل عند قراءة المعلومات الوراثية.
النيوكليوتيدات هي نيوكليوتيدات.
4.2 خصائص الحمض النووي كمادة وراثية والتباين
4.2.1 الاستنساخ الذاتي للمواد الوراثية. تكرار الحمض النووي
إحدى الخصائص الرئيسية لمادة الوراثة هي قدرتها على نسخ نفسها - التكرار. يتم توفير هذه الخاصية من خلال خصائص التنظيم الكيميائي لجزيء الحمض النووي ، والذي يتكون من خيطين متكاملين. في عملية النسخ المتماثل ، يتم تصنيع سلسلة تكميلية على كل سلسلة عديد النوكليوتيد من جزيء DNA الأصل. نتيجة لذلك ، يتكون حلزون مزدوج متطابقان من حلزون مزدوج للحمض النووي. تسمى هذه الطريقة لمضاعفة الجزيئات ، حيث يحتوي كل جزيء ابنة على أحد الوالدين وسلسلة صنعت حديثًا ، شبه متحفظ.
لحدوث النسخ المتماثل ، يجب فصل خيوط الدنا الأصلية عن بعضها البعض لتصبح قوالب يتم فيها تصنيع الخيوط التكميلية للجزيئات البنت.
يتم تنفيذ عملية النسخ المتماثل في مناطق خاصة من الحمض النووي ، المعينة أوري (من الأصل الإنجليزي - البداية). وهي تشتمل على تسلسل 300 زوج قاعدي تم التعرف عليه بواسطة بروتينات معينة. ينقسم اللولب المزدوج للحمض النووي في هذه المواقع إلى جزأين ، وكقاعدة عامة ، على جانبي أصل النسخ المتماثل ، تتشكل مناطق تباعد سلاسل عديد النوكليوتيد - شوكات النسخ المتماثل التي تتحرك في اتجاهين متعاكسين من موضع أوري. بين شوكات النسخ ، يتم تكوين بنية تسمى عين النسخ المتماثل ، حيث يتم تشكيل سلاسل عديد النوكليوتيد الجديدة على خيطين من الحمض النووي للأم (الشكل 8 ، أ).
بمساعدة إنزيم هيليكاز ، الذي يكسر روابط الهيدروجين ، يتفكك الحلزون المزدوج للحمض النووي عند نقاط منشأ التكاثر. ترتبط خيوط الحمض النووي المفردة الناتجة ببروتينات خاصة مزعزعة للاستقرار تمد العمود الفقري للسلاسل ، مما يجعل قواعدها النيتروجينية متاحة للارتباط بالنيوكليوتيدات التكميلية الموجودة في النيوكليوبلازم. في كل من السلاسل التي تم تشكيلها في منطقة شوكة النسخ ، بمشاركة إنزيم بوليميريز DNA ، يتم إجراء توليف السلاسل التكميلية (الشكل 8 ، ب).

الشكل 8. منطقة بدء النسخ المتماثل. شوكة النسخ المتماثل
أ. تكوين العين المتماثلة.
منطقة شوكة النسخ المتماثل في جزيء DNA
أثناء التوليف ، تتحرك شوكات النسخ على طول اللولب الأصلي في اتجاهات متعاكسة ، فتلتقط مناطق جديدة.
يؤدي فصل الخيوط الحلزونية للحمض النووي الأبوي عن طريق إنزيم هيليكاز إلى ظهور الفائق أمام شوكة النسخ. ويفسر ذلك حقيقة أنه مقابل كل 10 أزواج من النيوكليوتيدات التي تشكل دورة واحدة من اللولب ، يجب أن يكمل الحمض النووي الأصل دورة كاملة حول محوره. لذلك ، من أجل دفع شوكة النسخ المتماثل ، يجب أن يدور جزيء الحمض النووي بالكامل أمامه بسرعة ، الأمر الذي يتطلب إنفاقًا كبيرًا من الطاقة. لا يتم ملاحظة هذا في الواقع بسبب فئة خاصة من البروتينات تسمى DNA topoisomerases. يكسر Topoisomerase أحد خيوط الحمض النووي ، مما يسمح له بالدوران حول الشريط الثاني. هذا يضعف التوتر المتراكم في الحلزون المزدوج للحمض النووي (الشكل 9).
النيوكليوتيدات الحرة من النيوكليوبلازم ، حيث توجد في شكل جريفوسفات ديوكسي ريبونوكليوزيد: dATP ، dGTP ، dCTP ، dTTP ، تنضم إلى الروابط الهيدروجينية المحررة لتسلسل النيوكليوتيدات في السلاسل الأبوية المنفصلة. يشكل ثلاثي فوسفات النوكليوزيد التكميلي روابط هيدروجينية مع قاعدة محددة من خيط DNA الأصلي. ثم ، بمشاركة إنزيم بوليميريز الحمض النووي ، فإنه يرتبط برابطة فوسفوديستر بالنيوكليوتيدات السابقة للسلسلة المصنعة حديثًا ، مع إعطاء بيروفوسفات غير عضوي (الشكل 10).
نظرًا لأن بوليميريز الحمض النووي يضيف النيوكليوتيد التالي إلى مجموعة OH في الموضع 3 للنيوكليوتيدات السابقة ، فإن السلسلة تطول تدريجياً عند نهايتها 3.
تتمثل إحدى سمات بوليميريز الحمض النووي في عدم قدرته على بدء تخليق سلسلة جديدة من عديد النوكليوتيد ببساطة عن طريق ربط اثنين من ثلاثي فوسفات النوكليوزيد: الطرف 3 "-OH- لأي سلسلة بولي نيوكليوتيد مقترنة بسلسلة DNA النموذجية ، والتي لا يمكن إلا لبوليميراز الدنا أن تقوم بها إضافة نيوكليوتيدات جديدة مثل عديد النيوكليوتيدات تسمى سلسلة الليوتيد البذرة أو البادئة.
يتم تنفيذ دور التمهيدي لتخليق سلاسل عديد النوكليوتيد DNA أثناء النسخ المتماثل بواسطة تسلسلات قصيرة من الحمض النووي الريبي تتشكل بمشاركة إنزيم RNA primase (الشكل 11). تعني هذه الميزة لبوليميراز الحمض النووي أن سلسلة DNA التي تحمل أساسًا مزدوجًا ، والتي تحتوي على نهاية 3'-OH مجانية ، يمكن أن تعمل كقالب للنسخ المتماثل.

الشكل 9. كسر إحدى سلاسل الحمض النووي بمساعدة إنزيم DNA topoisomerase: يشكل I - DNA topoisomerase رابطة تساهمية مع إحدى مجموعات الحمض النووي الفوسفاتية (السلسلة العليا) ؛ II - نتيجة لكسر رابطة phosphodiester في سلسلة واحدة من polynucleotide حول الرابطة المقابلة للسلسلة الأخرى ، يحدث الدوران ، مما يخفف التوتر الناجم عن تباعد سلسلتي DNA في منطقة شوكة النسخ ؛ ثالثًا - بعد إطلاق التوتر في حلزون الحمض النووي ، يحدث الفصل التلقائي لـ DNA topoisomerase واستعادة رابطة phosphodiester في سلسلة DNA
إن قدرة بوليميراز الدنا على تجميع بولي نيوكليوتيد في الاتجاه من 5 "إلى 3" عندما يتم ربط خيطين من DNA بشكل معاكس يعني أن عملية النسخ يجب أن تستمر بشكل مختلف عليهما. في الواقع ، إذا كان تجميع سلسلة جديدة على إحدى المصفوفات (3 "→ 5") يحدث بشكل مستمر من نهاية 5 "إلى 3" ويتم إطالة هذه السلسلة تدريجيًا عند الطرف 3 ، ثم يتم تصنيع السلسلة الأخرى في المصفوفة (5 "→ 3") ، يجب أن تنمو من النهاية "3" إلى "5." وهذا مخالف لاتجاه عمل إنزيم بوليميريز DNA.

الشكل 10. إرفاق النوكليوتيدات التالية بشريط الدنا المُصنَّع بمشاركة بوليميراز الدنا: FF- بيروفوسفات
لقد ثبت الآن أن تركيب الخيط الثاني من الحمض النووي يتم بواسطة شظايا قصيرة (شظايا أوكازاكي) أيضًا في الاتجاه من 5 "إلى 3" (حسب نوع الخياطة "للخلف بإبرة") . في بدائيات النوى ، تحتوي شظايا Okazaki من 1000 إلى 2000 نيوكليوتيد ، في حقيقيات النوى تكون أقصر بكثير (من 100 إلى 200 نيوكليوتيد). يسبق تركيب كل جزء من هذا القبيل تشكيل تمهيدي RNA يبلغ طوله حوالي 10 نيوكليوتيدات. يرتبط الجزء الذي تم تشكيله حديثًا بالجزء السابق بمساعدة إنزيم DNA ligase بعد إزالة مادة RNA التمهيدي (الشكل 12 ، أ).
بسبب هذه الميزات ، فإن شوكة النسخ غير متماثل. من بين السلسلتين الوليقتين ، أحدهما مبني باستمرار ، وتكوينه أسرع ، وتسمى هذه السلسلة القائد. يكون تخليق السلسلة الأخرى أبطأ ، حيث يتم تجميعها من شظايا منفصلة تتطلب تكوين ثم إزالة مادة RNA التمهيدي. لذلك ، تسمى هذه السلسلة متخلفة (متخلفة). على الرغم من أن الأجزاء الفردية تتشكل في الاتجاه 5 "→ 3" ، بشكل عام ، تنمو هذه السلسلة في الاتجاه 3 "→ 5" (الشكل 3.12 ، أ). في ضوء حقيقة أن شوكتي النسخ المتماثل تبدأان عادةً من موضع ori ، وتذهبان في اتجاهين متعاكسين ، يحدث تخليق السلاسل الرئيسية فيهما على خيوط مختلفة من الحمض النووي للأم (الشكل 12 ، ب). النتيجة النهائية لعملية النسخ المتماثل هي تكوين جزيئين من الحمض النووي يتطابق تسلسل النيوكليوتيدات فيه مع تسلسل اللولب المزدوج الأصلي للحمض النووي.

الشكل 11. مخطط تفاعل لتخليق تمهيدي قصير من الحمض النووي الريبي المحفز بواسطة بريماز RNA
يشير التسلسل المدروس للأحداث التي تحدث في سياق التوليف التكراري إلى مشاركة نظام كامل من الإنزيمات: هيليكاز وتوبويزوميراز والبروتينات المزعزعة للاستقرار وبوليميراز الحمض النووي وغيرها ، تعمل معًا في منطقة شوكة النسخ المتماثل (الشكل 13). ).
يتشابه تكاثر الحمض النووي في الكائنات الأولية وحقيقيات النوى بشكل أساسي ، ومع ذلك ، فإن معدل التوليف في حقيقيات النوى (حوالي 100 نيوكليوتيد / ثانية) هو ترتيب من حيث الحجم أقل من بدائيات النوى (1000 نيوكليوتيد / ثانية). قد يكون السبب في ذلك هو تكوين دنا حقيقيات النوى من روابط قوية بما فيه الكفاية مع البروتينات ، مما يعيق عملية إزالة الفيروس ، وهو أمر ضروري للتوليف التكراري.
يشكل جزء الحمض النووي من نقطة أصل النسخ المتماثل إلى نقطة نهايته وحدة النسخ - النسخ المتماثل. بمجرد البدء في نقطة الأصل (في المكان) ، يستمر النسخ المتماثل حتى يتم تكرار النسخ المتماثل بأكمله. جزيئات الحمض النووي الدائرية للخلايا بدائية النواة لها واحد في الموقع وهي عبارة عن نسخ متماثلة منفصلة تمامًا. تحتوي الكروموسومات حقيقية النواة على عدد كبير من النسخ المتماثلة. في هذا الصدد ، يبدأ تكرار جزيء الحمض النووي الموجود على طول كروموسوم حقيقيات النواة في عدة نقاط. في النسخ المتماثلة المختلفة ، يمكن أن تحدث المضاعفة في أوقات مختلفة أو في وقت واحد.

أرز. 12. تخليق شريطين ابنتين من الدنا على خيوط مختلفة من الجزيء الأصل
ج: بسبب عدم التوازي بين خيوط الحمض النووي ، فإن تركيب خيوط الابنة يسير بشكل مختلف ؛ على خصلة الأب العليا ، يتم تصنيع خيط رئيسي بشكل مستمر ؛ على خصلة الوالد السفلية ، يتم تجميع حبلا الابنة من شظايا أوكازاكي - خصلة متخلفة.
يحدث توليف الخيوط الرائدة في شوكات متعددة الاتجاهات على خيوط مختلفة من الحمض النووي للأم
4.2.2 آليات الحفاظ على تسلسل الحمض النووي للنيوكليوزيد. الاستقرار الكيميائي. تكرار. بصلح
للحفاظ على الخصائص الرئيسية لخلية أو كائن حي طوال حياتهم ، وكذلك في عدد من الأجيال ، يجب أن تكون المادة الوراثية مقاومة للتأثيرات الخارجية أو يجب أن تكون هناك آليات لتصحيح التغييرات التي تحدث فيها. في الطبيعة ، يتم استخدام كلا العاملين. العامل الثالث هو دقة نسخ متواليات النيوكليوتيدات للحمض النووي للأم أثناء تكاثره.

الشكل 13. تشارك البروتينات في عملية تكرار الحمض النووي
تقوم هليكاز الحمض النووي بفك الحلزون المزدوج للحمض النووي ، وتفصل سلاسلها متعددة النوكليوتيدات ؛ تعمل البروتينات المزعزعة للاستقرار على تقويم جزء من سلسلة الحمض النووي ؛ يكسر DNA topoisomerase رابطة phosphodiester في أحد خيوط DNA polycarbonate ، مما يخفف من التوتر الناجم عن فك اللولب وفصل الجديلة عند شوكة النسخ ؛ يقوم RNA primase بتجميع مواد أولية RNA للحبلة الابنة ولكل جزء Okazaki ؛ يؤدي بوليميراز الدنا تخليقًا مستمرًا للخيط الرئيسي وتوليف شظايا أوكازاكي من الخيط المتأخر ؛ ligase DNA ligates شظايا Okazaki بعد إزالة RNA التمهيدي
من حيث التفاعل ، تصنف جزيئات الحمض النووي على أنها مواد خاملة كيميائيًا. من المعروف أن دور مادة الوراثة لا يمكن أن يؤديه الحمض النووي فحسب ، بل أيضًا الحمض النووي الريبي (بعض الفيروسات). يُعتقد أن الاختيار لصالح الحمض النووي يرجع إلى تفاعله المنخفض مقارنةً بـ RNA.
تتميز آلية النسخ التي تمت مناقشتها أعلاه بدقة عالية للغاية في استنساخ بنية الحمض النووي. عند تكرار الحمض النووي ، تحدث الأخطاء في المتوسط بتردد 1 · 10 -6 أزواج من القواعد التكميلية.
في الحفاظ على دقة عالية في النسخ المتماثل ، ينتمي دور مهم في المقام الأول إلى إنزيم بوليميريز الحمض النووي. يختار هذا الإنزيم النيوكليوتيدات اللازمة من بين ثلاثي الفوسفات النوكليوزيد (ATP ، TTP ، GTP ، CTP) الموجودة في النسغ النووي ، ويربطها بدقة بسلسلة قالب الحمض النووي وتضمينها في سلسلة الابنة المتزايدة. معدل تكرار إدراج النيوكليوتيدات غير الصحيحة في هذه المرحلة هو 1 · 10 -5 أزواج قاعدية.
ترتبط مثل هذه الأخطاء في عمل بوليميراز الدنا بظهور أشكال متغيرة من القواعد النيتروجينية ، والتي تشكل أزواجًا "غير قانونية" مع قواعد السلسلة الأم. على سبيل المثال ، شكل معدَّل من السيتوزين بدلاً من الجوانين هو الهيدروجين المرتبط بالأدينين. نتيجة لذلك ، يتم تضمين نيوكليوتيد خاطئ في سلسلة الحمض النووي المتنامية. يؤدي الانتقال السريع للشكل المعدل لمثل هذه القاعدة إلى الشكل المعتاد إلى تعطيل ارتباطه بالقالب ، وتظهر نهاية غير مقترنة 3 بوصات من سلسلة DNA المتنامية. في هذه الحالة ، يتم تنشيط آلية التصحيح الذاتي ، عن طريق بوليميراز DNA (أو إنزيم وثيق الصلة به - تحرير نوكلياز داخلي). يتكون التصحيح الذاتي من انقسام نيوكليوتيد خاطئ مدرج في سلسلة الحمض النووي غير المقترن بالقالب (الشكل 14). -التصحيح هو تقليل معدل الخطأ بمقدار 10 مرات (من 10 -5 إلى 10 -6).
على الرغم من فعالية التصحيح الذاتي ، تم الكشف عن الأخطاء أثناء النسخ المتماثل بعد تكرار الحمض النووي. غالبًا ما يتم ملاحظة ذلك عند اضطراب تركيز أربعة نيوكليوزيد ثلاثي الفوسفات في الركيزة المحيطة. يحدث جزء كبير من التغييرات أيضًا في جزيئات الحمض النووي نتيجة لعمليات عفوية مرتبطة بفقدان قواعد البيورين - الأدينين والجوانين (apurinization) - أو نزع أمين السيتوزين ، والذي يتحول إلى اليوراسيل. يصل معدل تكرار التغييرات الأخيرة إلى 100 لكل جينوم واحد في اليوم.
يمكن أن تتغير القواعد الموجودة في الحمض النووي تحت تأثير المركبات التفاعلية التي تعطل الاقتران الطبيعي ، وكذلك تحت تأثير الأشعة فوق البنفسجية ، والتي يمكن أن تسبب تكوين رابطة تساهمية بين بقايا ثايمين متجاورة في الحمض النووي (ثايمين ثايمرز). يجب أن تؤدي هذه التغييرات في الدورة التالية من النسخ المتماثل إما إلى فقدان أزواج القواعد في DNA الابنة ، أو إلى استبدال بعض الأزواج بأخرى. تصاحب هذه التغييرات كل دورة من تكرار الحمض النووي ، لكن تواترها أقل بكثير مما ينبغي. يفسر ذلك حقيقة أن معظم التغييرات من هذا النوع يتم التخلص منها بسبب عمل آلية الإصلاح (الاستعادة الجزيئية) لتسلسل نوكليوتيدات الحمض النووي الأصلي.
تعتمد آلية الإصلاح على وجود سلسلتين مكملتين في جزيء الحمض النووي. يتم الكشف عن تشويه تسلسل النوكليوتيدات في أحدها بواسطة إنزيمات معينة. ثم يتم إزالة الموقع المقابل واستبداله بموقع جديد ، يتم تصنيعه على خيط DNA التكميلي الثاني. يسمى هذا الإصلاح الاستئصالي ، أي مع "القطع" (الشكل 15). يتم تنفيذه قبل دورة النسخ التالية ، لذلك يُطلق عليه أيضًا اسم ما قبل النسخ المتماثل.

الشكل 14. مخطط عملية التصحيح أثناء تخليق الحمض النووي:
I- التضمين في سلسلة الحمض النووي للنيوكليوتيدات مع شكل معدل (توتوميري) من السيتوين ، والذي يتزاوج "بشكل غير قانوني" مع الأدينين ؛ II - يؤدي الانتقال السريع للسيتوزين إلى شكله الطبيعي إلى تعطيل الاقتران بالأدينين ؛ تمنع النهاية غير المزدوجة 3 -OH من السلسلة المركبة مزيدًا من الاستطالة تحت تأثير بوليميريز الحمض النووي ؛ ثالثًا - يزيل بوليميراز الحمض النووي النوكليوتيد غير القانوني ، ونتيجة لذلك تظهر نهاية 3 "-OH المقترنة بالقالب ؛ IV - يستمر بوليميراز الحمض النووي في تمديد السلسلة عند نهاية 3'-OH.
تتطلب استعادة بنية الحمض النووي الأصلية مشاركة عدد من الإنزيمات. من النقاط المهمة في بدء آلية الإصلاح اكتشاف خطأ في بنية الحمض النووي. غالبًا ما تحدث مثل هذه الأخطاء في الخيط المركب حديثًا أثناء النسخ المتماثل. يجب أن تكتشف إنزيمات الإصلاح هذه السلسلة بالضبط. في العديد من أنواع الكائنات الحية ، تختلف سلسلة الحمض النووي المُصنَّعة حديثًا عن درجة مثيلة قواعدها النيتروجينية عند الأمهات ، والتي تتخلف عن التوليف. في هذه الحالة ، تخضع السلسلة غير الميثلة للإصلاح. يمكن أيضًا أن يكون هدف التعرف على إنزيمات الإصلاح هو كسر في سلسلة الحمض النووي. في الكائنات الحية الأعلى ، حيث لا يحدث تخليق الحمض النووي بشكل مستمر ، ولكن بواسطة النسخ المتماثلة الفردية ، فإن سلسلة الحمض النووي المركبة حديثًا تنكسر ، مما يجعل من الممكن التعرف عليها. تتضمن استعادة بنية الحمض النووي في حالة فقد قواعد البيورين في إحدى سلاسله الكشف عن عيب باستخدام نوكلياز الإنزيم ، الذي يكسر رابطة الفوسفويستر في موقع تلف السلسلة. ثم تتم إزالة الموقع المتغير مع العديد من النيوكليوتيدات المجاورة له بواسطة إنزيم نوكلياز خارجي ، وفي مكانه ، وفقًا لترتيب قواعد السلسلة التكميلية ، يتم تشكيل تسلسل النوكليوتيدات الصحيح (الشكل 15).

الشكل 15. مخطط إصلاح الحمض النووي الاستئصالي قبل التكاثر.
عندما تتغير إحدى القواعد في سلسلة الحمض النووي ، يشارك حوالي 20 إنزيمًا من إنزيمات جليكوزيلاز الدنا في استعادة الهيكل الأصلي ، ويتعرفون على وجه التحديد على الضرر الناجم عن نزع الأمين ، والألكلة ، والتحولات الهيكلية الأخرى للقواعد. تتم إزالة هذه القواعد المعدلة. هناك مناطق خالية من القواعد ، يتم إصلاحها ، كما هو الحال مع فقدان البيورينات. إذا لم يتم تنفيذ استعادة الهيكل الطبيعي ، على سبيل المثال ، في حالة نزع أمين القواعد النيتروجينية ، يتم استبدال بعض أزواج القواعد التكميلية بأخرى - يمكن استبدال زوج C-G بزوج T-A ، إلخ. .
يتطلب تكوين ثايمين الثايمين (T-T) في سلاسل متعددة النوكليوتيد تحت تأثير الأشعة فوق البنفسجية مشاركة الإنزيمات التي لا تتعرف على القواعد الفردية المتغيرة ، ولكن الأضرار الأكثر شمولاً التي تلحق بهيكل الحمض النووي. ترتبط عملية الإصلاح في هذه الحالة أيضًا بإزالة الموقع الذي يحمل الثنائيات واستعادة تسلسل النوكليوتيدات الطبيعي عن طريق التوليف على خيط الحمض النووي التكميلي.
في حالة عدم قيام نظام إصلاح الختان بتصحيح التغيير الذي نشأ في أحد خيوط الحمض النووي ، أثناء النسخ المتماثل ، يتم إصلاح هذا التغيير ويصبح خاصية لكل من خيوط الحمض النووي. يؤدي هذا إلى استبدال زوج واحد من النيوكليوتيدات التكميلية بآخر أو ظهور فواصل (فجوات) في السلسلة المركبة حديثًا مقابل المناطق المتغيرة. يمكن أن تحدث استعادة بنية الحمض النووي الطبيعية أيضًا بعد النسخ المتماثل.
يتم إجراء الإصلاح ما بعد النسخ عن طريق إعادة التركيب (تبادل الشظايا) بين لولبين مزدوجين مكونين حديثًا من الحمض النووي. مثال على هذا الإصلاح اللاحق للتكرار هو استعادة بنية الحمض النووي الطبيعية عند ظهور ثايمين الثايمين (T-T) ، عندما لا يتم التخلص منها تلقائيًا تحت تأثير الضوء المرئي (الإصلاح الضوئي) أو أثناء الإصلاح الاستئصالي السابق للتكرار.
الروابط التساهمية التي تحدث بين بقايا الثايمين المجاورة تجعلها غير قادرة على الارتباط بالنيوكليوتيدات التكميلية. نتيجة لذلك ، تظهر الفواصل (الفجوات) التي يتم التعرف عليها بواسطة إنزيمات الإصلاح في خيط DNA المركب حديثًا. تتم استعادة سلامة سلسلة عديد النوكليوتيد الجديدة لأحد DNA الابنة بسبب إعادة التركيب مع سلسلة الأم الطبيعية المقابلة للحمض النووي الآخر للابنة. ثم يتم سد الفجوة المتكونة في السلسلة الأصلية عن طريق التوليف على سلسلة عديد النوكليوتيدات التكميلية (الشكل 16). يمكن اعتبار التبادل الملحوظ غالبًا للمواد بين الكروماتيدات الشقيقة (الشكل 17) مظهرًا من مظاهر الإصلاح اللاحق للتكرار ، الذي يتم إجراؤه عن طريق إعادة التركيب بين سلاسل جزيئين من جزيئات الحمض النووي.

الشكل 16. رسم تخطيطي لإصلاح الحمض النووي بعد التكرار:
أنا - حدوث ثايمين الثايمين في أحد خيوط الحمض النووي ؛
II - تكوين "فجوة" في الخيط المركب حديثًا مقابل المنطقة المتغيرة للجزيء الأصلي بعد التكرار (يشير السهم إلى الملء اللاحق لـ "الفجوة" بمنطقة من الخيط المقابل لجزيء DNA الابنة الثانية) ؛
ثالثًا - استعادة سلامة السلسلة الوليدة للجزيء العلوي بسبب إعادة التركيب وفي الجزيء السفلي بسبب التوليف على السلسلة التكميلية

الشكل 17. التبادلات بين الكروماتيد (يشار إليها بالسهام)
في سياق الإصلاح قبل التكاثر وما بعد التكرار ، تتم استعادة معظم الأضرار التي لحقت بهيكل الحمض النووي. ومع ذلك ، في حالة حدوث ضرر كبير في المادة الوراثية للخلية ولم يتم القضاء على بعضها ، يتم تشغيل نظام إنزيمات الإصلاح المحرضة (المثارة) (نظام SOS). تملأ هذه الإنزيمات الفجوات من خلال استعادة سلامة سلاسل البولي نيوكليوتيد المركبة دون التقيد الصارم بمبدأ التكامل. هذا هو السبب في أن عمليات الإصلاح نفسها في بعض الأحيان يمكن أن تكون بمثابة مصدر للتغييرات المستمرة في بنية الحمض النووي (الطفرات). ينطبق التفاعل المسمى أيضًا على نظام SOS.
إذا ظل مقدار الضرر الذي يلحق ببنية الحمض النووي في الخلية مرتفعًا ، على الرغم من الإصلاح المستمر ، يتم حظر عمليات تكرار الحمض النووي فيها. مثل هذه الخلية لا تنقسم ، مما يعني أنها لا تنقل التغييرات التي نشأت إلى النسل.
يمكن أن يؤدي إيقاف دورة الخلية الناجم عن تلف الحمض النووي ، جنبًا إلى جنب مع استحالة الإصلاح الجزيئي للمادة الوراثية المعدلة ، إلى تنشيط عملية الذات. - تدمير (موت الخلايا المبرمج) لخلية معيبة لإزالتها من الجسم.
وهكذا ، تقوم مجموعة واسعة من إنزيمات الإصلاح المختلفة بإجراء "فحص" مستمر للحمض النووي ، وإزالة المناطق التالفة منه والمساعدة في الحفاظ على استقرار المادة الوراثية. يضمن العمل المشترك لإنزيمات النسخ المتماثل (بوليميريز الحمض النووي وتحرير نوكلياز داخلي) وإنزيمات الإصلاح معدل خطأ منخفض إلى حد ما في جزيئات الحمض النووي ، والذي يتم الحفاظ عليه عند مستوى 1 × 10 -9 أزواج من النيوكليوتيدات المتغيرة لكل جينوم. مع حجم الجينوم البشري 3 × 10 9 أزواج قاعدية ، هذا يعني حوالي 3 أخطاء لكل جينوم مكرر. في الوقت نفسه ، حتى هذا المستوى كافٍ لتشكيل تنوع جيني مهم في شكل طفرات جينية أثناء وجود الحياة على الأرض.
4.2.3 التغييرات في متواليات نوكليوتيدات الدنا.
التغييرات غير المصححة في التركيب الكيميائي للجينات ، والتي تتكاثر في دورات متتالية من التكاثر وتتجلى في النسل في شكل متغيرات جديدة من السمات ، تسمى الطفرات الجينية.
يمكن تقسيم التغييرات في بنية الحمض النووي التي يتكون منها الجين إلى ثلاث مجموعات. تتكون طفرات المجموعة الأولى في استبدال بعض القواعد بأخرى. تشكل حوالي 20٪ من التغيرات الجينية التي تحدث بشكل عفوي. تحدث المجموعة الثانية من الطفرات بسبب تحول الإطار الذي يحدث عندما يتغير عدد أزواج النوكليوتيدات في الجين. أخيرًا ، يتم تمثيل المجموعة الثالثة بطفرات مرتبطة بتغيير في ترتيب تسلسل النوكليوتيدات داخل الجين (الانقلاب).
الطفرات حسب نوع استبدال القواعد النيتروجينية. تحدث هذه الطفرات لعدد من الأسباب المحددة. قد يكون أحدها تغييرًا في بنية القاعدة التي تم تضمينها بالفعل في حلزون الحمض النووي ، والذي يحدث بالصدفة أو تحت تأثير عوامل كيميائية معينة. إذا ظل هذا الشكل المعدل للقاعدة دون أن يلاحظه أحد من قبل إنزيمات الإصلاح ، فعندئذٍ خلال دورة النسخ التالية يمكن أن يعلق نوكليوتيد آخر بنفسه. ومن الأمثلة على ذلك نزع الأمين من السيتوزين ، والذي يتحول إلى اليوراسيل تلقائيًا أو تحت تأثير حمض النيتروز (الشكل 18). يتحد اليوراسيل الناتج ، الذي لم يلاحظه إنزيم جليكوسيلاز الحمض النووي ، أثناء النسخ المتماثل مع الأدينين ، والذي يربط لاحقًا نوكليوتيد الثيميديل. نتيجة لذلك ، يتم استبدال الزوج C-G في الحمض النووي بزوج T-A (الشكل 19 ، I). نزع الأمين من السيتوزين الميثلي يحوله إلى الثايمين (انظر الشكل 3.18). نوكليوتيد الثيميديل ، كونه مكونًا طبيعيًا للحمض النووي ، لا يتم اكتشافه كتغيير بواسطة إنزيمات الإصلاح ويضيف نوكليوتيد الأدينيل أثناء التكرار التالي. نتيجة لذلك ، بدلاً من زوج C-G ، يظهر زوج T-A أيضًا في جزيء DNA (الشكل 19 ، II).

الشكل 18. نزع الأمين العفوي من السيتوزين
قد يكون السبب الآخر لاستبدال القواعد هو التضمين الخاطئ في سلسلة DNA المركبة لنيوكليوتيد يحمل شكلًا معدلًا كيميائيًا للقاعدة أو نظيرها. إذا ظل هذا الخطأ دون أن يلاحظه أحد من خلال إنزيمات النسخ والإصلاح ، فسيتم تضمين القاعدة المتغيرة في عملية النسخ المتماثل ، مما يؤدي غالبًا إلى استبدال زوج واحد بآخر. مثال على ذلك هو إضافة نيوكليوتيد مع 5-بروموراسيل (5-BU) ، على غرار نوكليوتيد ثيميديل ، إلى الأدينين في سلسلة الأمهات أثناء التكاثر. أثناء النسخ المتماثل اللاحق ، يعلق 5-BU بسهولة أكبر على نفسه ليس بالأدينين ، ولكن الجوانين. يشكل الجوانين في سياق المزيد من المضاعفة زوجًا مكملًا مع السيتوزين. نتيجة لذلك ، يتم استبدال زوج A-T في جزيء DNA بواسطة زوج G-C (الشكل 20).

أرز. 19. الطفرات حسب نوع الاستبدال الأساسي (نزع أمين القواعد النيتروجينية في سلسلة الحمض النووي):
I - تحويل السيتوزين إلى اليوراسيل ، واستبدال زوج C-G بزوج T-A ؛
II - تحويل ميثيل سيتوزين إلى ثايمين ، واستبدال زوج C-G بزوج T-A
من الأمثلة المذكورة أعلاه ، يمكن ملاحظة أن التغييرات في بنية جزيء الحمض النووي حسب نوع الاستبدال الأساسي تحدث إما قبل أو أثناء النسخ المتماثل ، في البداية في سلسلة واحدة من عديد النوكليوتيدات. إذا لم يتم تصحيح هذه التغييرات أثناء الإصلاح ، فعندئذ أثناء النسخ المتماثل اللاحق تصبح ملكية لكلا خيوط الحمض النووي.

أرز. 20. الطفرات حسب نوع الاستبدال الأساسي (إدراج نظير قاعدة نيتروجينية في تكرار الحمض النووي)
نتيجة استبدال زوج واحد من النيوكليوتيدات التكميلية بآخر هو تكوين ثلاثي جديد في تسلسل نوكليوتيد الحمض النووي الذي يشفر تسلسل الأحماض الأمينية في سلسلة الببتيد. قد لا يؤثر هذا على بنية الببتيد إذا كان الثلاثي الجديد "مرادفًا" للسابق ، أي سوف يرمز لنفس الحمض الأميني. على سبيل المثال ، يتم تشفير حمض أميني فالين بأربعة توائم: CAA ، CAG ، CAT ، CAC. إن استبدال القاعدة الثالثة في أي من هذه الثلاثة توائم لن يغير معناها (انحطاط الكود الجيني).
في الحالة التي يشفر فيها الثلاثي الجديد حديثًا حمض أميني آخر ، تتغير بنية سلسلة الببتيد وخصائص البروتين المقابل. اعتمادًا على طبيعة ومكان الاستبدال ، تتغير الخصائص المحددة للبروتين بدرجات متفاوتة. تُعرف الحالات عندما يؤثر استبدال حمض أميني واحد فقط في الببتيد بشكل كبير على خصائص البروتين ، والذي يتجلى في تغيير في ميزات أكثر تعقيدًا. مثال على ذلك هو التغيير في خصائص الهيموجلوبين البشري في فقر الدم المنجلي (الشكل 21). في مثل هذا الهيموجلوبين- (HbS) (على عكس HbA الطبيعي) - في سلاسل p-globin في الموضع السادس ، يتم استبدال حمض الجلوتاميك بالفالين. هذا نتيجة لاستبدال إحدى القواعد في حمض الجلوتاميك الثلاثي المشفر (CTT أو CTC). نتيجة لذلك ، يظهر Valine ثلاثي التشفير (CAT أو CAC). في هذه الحالة ، يؤدي استبدال حمض أميني واحد في الببتيد إلى تغيير كبير في خصائص الغلوبين ، وهو جزء من الهيموغلوبين (تقل قدرته على الارتباط بـ 02) ، ويظهر لدى الشخص علامات فقر الدم المنجلي.
في بعض الحالات ، يمكن أن يؤدي استبدال قاعدة بأخرى إلى ظهور أحد التوائم الثلاثة غير المعقول (ATT ، ATC ، ACT) الذي لا يرمز إلى أي حمض أميني. ستكون نتيجة هذا الاستبدال انقطاع تخليق سلسلة الببتيد. تشير التقديرات إلى أن بدائل النوكليوتيدات في ثلاثة توائم تؤدي في 25٪ من الحالات إلى تكوين ثلاثة توائم مترادفة ؛ في 2-3 - ثلاثة توائم لا معنى لها ، 70-75 ٪ - لحدوث طفرات جينية حقيقية.
وبالتالي ، يمكن أن تنشأ طفرات استبدال القاعدة نتيجة للتغييرات التلقائية في البنية الأساسية في أحد خيوط حلزون مزدوج موجود بالفعل للحمض النووي ، وأثناء النسخ المتماثل في حبلا مركب حديثًا. إذا لم يتم تصحيح هذه التغييرات أثناء الجبر (أو ، على العكس من ذلك ، تحدث أثناء الجبر) ، يتم إصلاحها في كلتا السلسلتين ثم إعادة إنتاجها في دورات النسخ التالية. لذلك ، فإن أحد المصادر المهمة لمثل هذه الطفرات هو انتهاكات عمليات النسخ والإصلاح.
الطفرات مع تحول في إطار القراءة. يشكل هذا النوع من الطفرات نسبة كبيرة من الطفرات العفوية. تحدث بسبب فقدان أو إدخال زوج واحد أو أكثر من النيوكليوتيدات التكميلية في تسلسل نوكليوتيدات الحمض النووي. تم العثور على معظم طفرات انزياح الإطارات المدروسة في تسلسلات تتكون من نيوكليوتيدات متطابقة.
يتم تسهيل التغيير في عدد أزواج النوكليوتيدات في سلسلة DNA من خلال التأثيرات على المادة الوراثية لبعض المواد الكيميائية ، مثل مركبات الأكريدين. من خلال تشويه بنية الحلزون المزدوج للحمض النووي ، فإنها تؤدي إلى إدخال قواعد إضافية أو فقدانها أثناء النسخ المتماثل. مثال على ذلك هو الطفرات التي تم الحصول عليها في T4 Phage عند التعرض للبروفلافين. وهي تتكون من تضمين أو إزالة زوج نيوكليوتيد واحد فقط. يمكن أن يكون التشعيع بالأشعة السينية سببًا مهمًا للتغيير في عدد أزواج النوكليوتيدات في الجين وفقًا لنوع الانقسامات الكبيرة (التداعيات). في ذبابة الفاكهة ، على سبيل المثال ، تُعرف طفرة في الجين الذي يتحكم في لون العين ، والتي تنتج عن التشعيع وتتكون من انقسام حوالي 100 زوج من النوكليوتيدات.

الشكل 21. التأثير متعدد الاتجاهات لاستبدال حمض أميني واحد في سلسلة β من الهيموغلوبين البشري مما يؤدي إلى تطور فقر الدم المنجلي
يحدث عدد كبير من الطفرات من نوع الإدراج بسبب إدراج العناصر الوراثية المتنقلة ، الينقولات ، في تسلسل النيوكليوتيدات. الينقولات عبارة عن تسلسلات نيوكليوتيد طويلة إلى حد ما مدمجة في جينومات الخلايا الحقيقية والخلايا بدائية النواة التي يمكنها تغيير موضعها تلقائيًا. مع وجود احتمال معين ، يمكن أن تحدث عمليات الإدخال والانقسامات نتيجة لأخطاء إعادة التركيب مع عبور غير متكافئ داخل الجين (الشكل 22).

الشكل 22. الطفرات Frameshift (التبادل غير المتكافئ مع العبور داخل الجين):
I - تكسر جينات allelpy في مناطق مختلفة وتبادل الشظايا بينها ؛
II - فقدان الزوجين الثالث والرابع من النيوكليوتيدات ، وهو تحول في إطار القراءة ؛
III - مضاعفة الزوجين الثالث والرابع من النيوكليوتيدات ، وتحويل إطار القراءة

الشكل 23. نتيجة التغيير في عدد أزواج النوكليوتيدات في جزيء الحمض النووي
يؤدي تحول إطار القراءة نتيجة إدخال نيوكليوتيد واحد في السلسلة المشفرة إلى تغيير في تكوين الببتيد المشفر فيه
مع استمرار القراءة وعدم تداخل الشفرة الجينية ، يؤدي التغيير في عدد النيوكليوتيدات ، كقاعدة عامة ، إلى تحول في إطار القراءة وتغيير في معنى المعلومات البيولوجية المسجلة في تسلسل DNA معين (الشكل 23). ومع ذلك ، إذا كان عدد النيوكليوتيدات التي تم إدخالها أو فقدها مضاعفًا لثلاثة ، فقد لا يحدث انزياح الإطار ، ولكنه سينتج عنه إدراج أحماض أمينية إضافية أو فقدان بعضها من سلسلة البولي ببتيد. إحدى النتائج المحتملة لتغيير الإطارات هي ظهور تجاعيد غير منطقية ، مما يؤدي إلى تخليق سلاسل الببتيد المختصرة.
الطفرات حسب نوع انعكاس تسلسل النوكليوتيدات في الجين. يحدث هذا النوع من الطفرات بسبب دوران 180 درجة لجزء من الحمض النووي. عادة ، يسبق ذلك تكوين حلقة بواسطة جزيء DNA ، حيث يستمر النسخ المتماثل في الاتجاه المعاكس للاتجاه الصحيح.
داخل المنطقة المقلوبة ، تتعطل قراءة المعلومات ، ونتيجة لذلك يتغير تسلسل الأحماض الأمينية للبروتين.
4.2.4 الوحدات الأولية للتغير المادة الوراثية. موتون. ريكون
الجين هو وحدة أولية لوظيفة المادة الوراثية. هذا يعني أن جزءًا من جزيء DNA يتوافق مع جين فردي ويحدد ، بفضل المعلومات البيولوجية الموجودة فيه ، إمكانية تطوير سمة معينة ، غير قابل للتجزئة أيضًا بمعنى وظيفي. تشير المعلومات حول الطفرات الجينية الموضحة أعلاه إلى أهمية التغييرات في التركيب الكيميائي التي لا تؤثر على الجين بأكمله ، ولكن على أقسامه الفردية ، ونتيجة لذلك تظهر المتغيرات الجديدة للسمة.
الحد الأدنى لمقدار المادة الوراثية التي يمكن أن تؤدي ، عند التغيير ، إلى ظهور متغيرات للسمة ، والتي تتوافق مع الوحدة الأولية لعملية الطفرة وتسمى الضأن. تشير أمثلة الطفرات الجينية التي نوقشت أعلاه إلى أنه يكفي استبدال زوج واحد من القواعد التكميلية في الجين من أجل تغيير خصائص البروتين الذي يشفره. وهكذا ، فإن لحم الخنزير يتوافق مع زوج واحد من النيوكليوتيدات التكميلية.
يحدث جزء من الطفرات الجينية حسب نوع عمليات الإدخال والحذف لأزواج النوكليوتيدات بسبب التبادل غير المتكافئ بين جزيئات الحمض النووي أثناء العبور ، أي في انتهاك لإعادة التركيب بينهما. ويصاحب ذلك تحول في إطار القراءة ويؤدي إلى اضطراب في تركيب سلسلة الببتيد بالخصائص المرغوبة. تظهر الملاحظات أن إدخال أو حذف زوج واحد من النيوكليوتيدات يكفي لتشويه المعلومات البيولوجية المسجلة في الجين. مما قيل ، يترتب على ذلك أن الوحدة الأولية لإعادة التركيب ، وإعادة التركيب ، تتوافق على المستوى الجزيئي مع زوج واحد من النيوكليوتيدات.
تؤدي التغييرات في تسلسل النوكليوتيدات التي تنشأ تلقائيًا أو تحت تأثير التأثيرات الخارجية المختلفة إلى حقيقة أن نفس الجين يمكن أن يوجد في العديد من المتغيرات التي تختلف في المعلومات البيولوجية الواردة فيها. يُطلق على الشكل المحدد لوجود الجين ، والذي يحدد إمكانية تطوير متغير معين لسمة معينة ، الأليل. توجد أليلات الجين في نفس المنطقة - موضع - لكروموسوم معين ، والذي يمكن أن يحتوي في نفس الوقت على واحد فقط من سلسلة الأليلات. هذا يجعل الأليلات خيارات بديلة (متنافية) لوجود الجين.
يمكن أن تحدث التغييرات في التركيب الكيميائي في مناطق مختلفة من الجين. إذا كانت متوافقة مع الحياة ، أي. لا تؤدي إلى موت الخلايا أو الكائنات الحية - ناقلات هذه الطفرات ، يتم تخزينها جميعًا في مجموعة الجينات الخاصة بالأنواع.
يسمى التواجد في البركة الجينية للأنواع في نفس الوقت الأليلات المختلفة للجين بالأليل المتعدد. مثال على ذلك هو خيارات ألوان العين المختلفة في ذبابة الفاكهة: الأبيض ، الكرز ، الأحمر ، المشمش ، الإيوزين ، بسبب الأليلات المختلفة للجين المقابل. في البشر ، كما هو الحال في الممثلين الآخرين للعالم العضوي ، تعد الأليلة المتعددة مميزة للعديد من الجينات. لذلك ، تحدد ثلاثة أليلات من الجين I فصيلة الدم وفقًا لنظام AB0 (I A ، I B ، I 0). يحتوي الجين الذي يحدد الانتماء Rh على أليلين. أكثر من مائة أليلات لها جينات لـ α- و-polypeptides من الهيموجلوبين.
سبب الأليلة المتعددة هي التغييرات العشوائية في بنية الجين (الطفرات) المحفوظة في عملية الانتقاء الطبيعي في مجموعة الجينات للسكان. يحدد تنوع الأليلات التي تتحد أثناء التكاثر الجنسي درجة التنوع الوراثي بين ممثلي نوع معين ، وهو أمر ذو أهمية تطورية كبيرة ، مما يزيد من قابلية السكان للحياة في ظل الظروف المتغيرة لوجودهم. بالإضافة إلى الأهمية التطورية والبيئية ، فإن الحالة الأليلية للجينات لها تأثير كبير على عمل المادة الوراثية. في الخلايا الجسدية ثنائية الصبغة للكائنات حقيقية النواة ، يتم تمثيل معظم الجينات بواسطة أليلين يؤثران معًا في تكوين السمات.
4.2.5 التصنيف الوظيفي للطفرات الجينية
التغييرات في بنية الجين ، كقاعدة عامة ، غير مواتية ، مما يقلل من صلاحية الخلية والكائن الحي (الطفرات الضارة) ، وأحيانًا تؤدي إلى موتهم (طفرات قاتلة). نادرًا ما لا تؤثر الطفرات التي تحدث بشكل كبير على قابلية حامليها للحياة ، لذلك تعتبر محايدة. أخيرًا ، نادرًا ما تظهر الأليلات التي لها تأثير مفيد (الطفرات المفيدة) ، مما يمنح حامليها بقاءًا تفضيليًا. في معظم الحالات ، يعمل الأليل الذي ظهر حديثًا للجين باعتباره متنحيًا فيما يتعلق بأليل النوع "البري" الشائع في الطبيعة ، أي لا يظهر في تركيبة معها. لكن في بعض الأحيان يمكن أن يكون الشكل المتحور للجين هو المسيطر ، أي يقمع مظهر الأليل "البري" ، وهو أكثر شيوعًا في تجمع الجينات من السكان.
4.2.6 الآليات التي تقلل الآثار الضارة الطفرات الجينية
نتيجة للطفرات الجينية ، يتغير معنى المعلومات البيولوجية. يمكن أن تكون عواقب هذا ذات شقين. في البيئات التي لا تتغير كثيرًا ، عادةً ما تقلل المعلومات الجديدة من البقاء على قيد الحياة. مع حدوث تغيير حاد في ظروف الوجود ، مع تطور مكانة إيكولوجية جديدة ، يكون توافر المعلومات المختلفة مفيدًا. في هذا الصدد ، يتم الحفاظ على شدة عملية الطفرات في ظل الظروف الطبيعية عند مستوى لا يسبب انخفاضًا كارثيًا في قابلية بقاء النوع. دور مهم في الحد من الآثار السلبية للطفرات ينتمي إلى آليات مكافحة الطفرات التي نشأت في التطور.
تمت مناقشة بعض هذه الآليات أعلاه. نحن نتحدث عن ميزات عمل بوليميراز الحمض النووي ، الذي يختار النيوكليوتيدات المطلوبة في عملية تكرار الحمض النووي ، ويقوم أيضًا بإجراء التصحيح الذاتي أثناء تكوين حبلا DNA جديد ، إلى جانب تحرير نوكلياز داخلي. يتم تحليل الآليات المختلفة لإصلاح بنية الحمض النووي ودور انحطاط الكود الجيني بالتفصيل. الحل لهذه المشكلة هو الطبيعة الثلاثية للشفرة البيولوجية ، والتي تسمح بالحد الأدنى من البدائل داخل الثلاثي ، مما يؤدي إلى تشويه المعلومات. وهكذا ، فإن 64٪ من بدائل النوكليوتيدات الثالثة في ثلاثة توائم لا تغير معناها الدلالي. صحيح أن بدائل النوكليوتيدات الثانية بنسبة 100٪ تؤدي إلى تشويه معنى الثلاثي.
يعمل اقتران الكروموسومات في النمط النووي ثنائي الصبغيات للخلايا الجسدية حقيقية النواة كعامل حماية ضد العواقب السلبية للطفرات الجينية.
يمنع اقتران أليلات الجينات المظهر الظاهري للطفرات إذا كانت متنحية.
يتم تقديم مساهمة معينة في الحد من الآثار الضارة للطفرات الجينية من خلال ظاهرة extracopying للجينات التي تشفر الجزيئات الحيوية. وهو يتألف من وجود عدة عشرات وأحيانًا مئات النسخ المتطابقة من هذه الجينات في النمط الجيني. مثال على ذلك هو جينات الرنا الريباسي ، الرنا الريباسي ، بروتينات الهيستون ، والتي بدونها يكون النشاط الحيوي لأي خلية مستحيلاً.
في وجود النسخ الخارجية ، لا يؤدي التغيير الطفري في جين واحد أو حتى عدة جينات متطابقة إلى عواقب وخيمة على الخلية. النسخ التي تظل دون تغيير كافية لضمان الأداء الطبيعي.
إن عدم التكافؤ الوظيفي لبدائل الأحماض الأمينية في عديد الببتيد ضروري أيضًا. إذا كانت الأحماض الأمينية الجديدة والمستبدلة متشابهة في الخصائص الفيزيائية والكيميائية ، فإن التغييرات في البنية الثلاثية والخصائص البيولوجية للبروتين تكون غير مهمة.
وبالتالي ، يختلف الهيموجلوبين البشري HbS و HbC عن الهيموغلوبين الطبيعي HbA باستبدال سلسلة p حمض الجلوتاميك في الموضع السادس بالفالين أو اللايسين ، على التوالي. يغير البديل الأول خصائص الهيموجلوبين بشكل كبير ويؤدي إلى تطور مرض خطير - فقر الدم المنجلي.
مع الاستبدال الثاني ، تتغير خصائص الهيموجلوبين إلى حد أقل بكثير.
والسبب في هذه الاختلافات هو أن حمض الجلوتاميك والليسين يظهران خصائص محبة للماء مماثلة ، بينما حمض الفالين حمض أميني كاره للماء.
وبالتالي ، فإن هذه الآليات تساهم في الحفاظ على الجينات المختارة أثناء التطور ، وفي نفس الوقت ، تراكم أليلاتها المختلفة في مجموعة الجينات للسكان ، مما يشكل احتياطيًا من التباين الوراثي. يحدد الأخير المرونة التطورية العالية للسكان ، أي القدرة على البقاء في ظروف مختلفة.
4.3 استخدام المعلومات الجينية في عمليات الحياة
4.3.1 دور RNA في تحقيق المعلومات الوراثية
يتم تخزين المعلومات الوراثية ، التي يتم تدوينها بمساعدة الشفرة الجينية ، في جزيئات الحمض النووي وتتضاعف من أجل تزويد الخلايا المشكلة حديثًا بـ "التعليمات" الضرورية لتطورها وعملها الطبيعي. في الوقت نفسه ، لا يشارك الحمض النووي بشكل مباشر في دعم حياة الخلايا. دور الوسيط ، الذي تتمثل وظيفته في ترجمة المعلومات الوراثية المخزنة في الحمض النووي إلى شكل عامل ، يتم لعبه بواسطة الأحماض النووية الريبية - RNA.
على عكس جزيئات الحمض النووي ، يتم تمثيل الأحماض النووية الريبية من خلال سلسلة واحدة من عديد النوكليوتيدات ، والتي تتكون من أربعة أنواع من النيوكليوتيدات التي تحتوي على السكر والريبوز والفوسفات وأحد القواعد النيتروجينية الأربعة - الأدينين ، الجوانين ، اليوراسيل أو السيتوزين. يتم تصنيع الحمض النووي الريبي (RNA) على جزيئات الحمض النووي باستخدام إنزيمات بوليميراز الحمض النووي الريبي وفقًا لمبدأ التكامل والتوازي ، ويعتبر اليوراسيل مكملاً لأدينين الحمض النووي الريبي في الحمض النووي الريبي. يمكن تقسيم المجموعة الكاملة من RNAs التي تعمل في الخلية إلى ثلاثة أنواع رئيسية: mRNA ، و tRNA ، و rRNA.
مصفوفة ، أو معلومات ، الحمض النووي الريبي (مرنا ، أو مرنا). النسخ. من أجل تصنيع البروتينات ذات الخصائص المرغوبة ، تأتي "تعليمات" حول الترتيب الذي يتم فيه تضمين الأحماض الأمينية في سلسلة الببتيد إلى موقع بنائها. هذه التعليمات واردة في تسلسل النيوكليوتيدات للمصفوفة ، أو معلومات الحمض النووي الريبي (مرنا ، مرنا) المركبة في مناطق الحمض النووي المقابلة. تسمى عملية تخليق الرنا المرسال النسخ.
يبدأ تركيب الرنا المرسال باكتشاف بوليميراز الحمض النووي الريبي لموقع خاص في جزيء الحمض النووي ، مما يشير إلى موقع بداية النسخ - المحفز. بعد التعلق بالمُحفِّز ، يقوم بوليميراز الحمض النووي الريبي بفك المنعطف المجاور لحلزون الحمض النووي. يتباعد عند هذه النقطة خيطان من الحمض النووي ، ويصنع الإنزيم على أحدهما الرنا المرسال. يحدث تجميع الريبونوكليوتيدات في سلسلة بالتوافق مع تكاملها مع نيوكليوتيدات الحمض النووي ، وأيضًا بشكل مضاد للتوازي مع سلسلة DNA النموذجية. نظرًا لحقيقة أن بوليميراز الحمض النووي الريبي قادر على تجميع بولي نيوكليوتيد فقط من الطرف 5 إلى النهاية 3 ، يمكن أن يعمل واحد فقط من خيطي DNA كقالب للنسخ ، أي الذي يواجه الإنزيم بـ 3 'end (3 "→ 5"). تسمى هذه السلسلة كودوجينيك (الشكل 3.24) ، والتوازي المضاد لوصلة سلسلتين عديد النوكليوتيد في جزيء DNA يسمح لـ RNA polymerase باختيار قالب تخليق mRNA بشكل صحيح.
بالانتقال على طول سلسلة الحمض النووي المشفر ، يقوم بوليميراز الحمض النووي الريبي بإعادة كتابة تدريجية ودقيقة للمعلومات حتى يواجه تسلسل نوكليوتيد محدد - فاصل نسخ. في هذه المنطقة ، يتم فصل بوليميراز الحمض النووي الريبي من قالب DNA وعن mRNA المركب حديثًا (الشكل 25). يشكل جزء من جزيء الحمض النووي ، بما في ذلك المحفز ، والتسلسل المكتوب والمُنهي ، وحدة نسخ - نسخة.
أثناء التوليف ، بينما يتحرك بوليميراز الحمض النووي الريبي على طول جزيء الحمض النووي ، يتم مرة أخرى دمج الأجزاء التي تقطعت بها السبل من الحمض النووي الذي مر من خلاله في حلزون مزدوج. يحتوي الرنا المرسال المتكون أثناء النسخ على نسخة طبق الأصل من المعلومات المسجلة في القسم المقابل من الحمض النووي. ثلاثة نيوكليوتيدات مرنا متجاورة ترمز للأحماض الأمينية تسمى الكودونات. رموز تسلسل كودون mRNA لتسلسل الأحماض الأمينية في سلسلة الببتيد. تتوافق أكواد mRNA مع بعض الأحماض الأمينية (الجدول 1).
الجدول 1. الكود الجيني للـ mRNA (تم وضع خط تحته خط رموز إنهاء). النوكليوتيدات الثانية
| في | ج | أ | جي | ||||||||

الشكل 24. مخطط التوليف مرنا
القالب الخاص بنسخ الرنا المرسال هو خيط الحمض النووي المشفر الذي يواجه الإنزيم بنهايته الثلاثية

أرز. 25. دور بوليميراز الحمض النووي الريبي في النسخ:
I - الكشف عن منطقة المروج في جزيء DNA وفك حلزون DNA ؛ II - الشروع في تخليق سلسلة الحمض النووي الريبي عن طريق ربط أول جريفوسفات ريبونوكليوزيد ؛ III - تمديد سلسلة RNA في الاتجاه 5 "→ 3" عن طريق ربط ribonucleoside gryphosphates ؛ IV - إطلاق الطرف 5 بوصات من الحمض النووي الريبي المركب واستعادة الحلزون المزدوج للحمض النووي ؛ الخامس - استكمال تخليق الحمض النووي الريبي في منطقة النهاية ، وفصل البوليميراز عن سلسلة الحمض النووي الريبي المكتملة
نقل الحمض النووي الريبي (الحمض النووي الريبي). إذاعة. يلعب نقل الحمض النووي الريبي (الحمض النووي الريبي) دورًا مهمًا في عملية استخدام المعلومات الوراثية بواسطة الخلية. تسليم الأحماض الأمينية الضرورية إلى موقع تجميع سلاسل الببتيد ، يعمل الحمض الريبي النووي النقال كوسيط متعدية.
جزيئات الحمض النووي الريبي (tRNA) عبارة عن سلاسل متعددة النوكليوتيد يتم تصنيعها على تسلسلات محددة من الحمض النووي. تتكون من عدد صغير نسبيًا من النيوكليوتيدات - 75-95. نتيجة للتوصيل التكميلي للقواعد الموجودة في أجزاء مختلفة من سلسلة عديد النوكليوتيد الحمض الريبي النووي النقال ، فإنه يكتسب بنية تشبه ورقة البرسيم في الشكل (الشكل 26).

الشكل 26. هيكل جزيء الحمض الريبي النووي النقال النموذجي
يتكون من أربعة أجزاء رئيسية تؤدي وظائف مختلفة. يتكون "الساق" المتلقي من جزأين طرفيين متصلين من الحمض الريبي النووي النقال (tRNA). يتكون من سبعة أزواج قاعدية ، ويتكون وسط هذه الفروع - anticodon - من خمسة أزواج من النيوكليوتيدات وتحتوي على anticodon في وسط حلقتها. هذا الحمض الريبي النووي النقال إلى موقع تخليق الببتيد.
بين الفروع المستقبلة و anticodon فرعين جانبيين. في حلقاتها ، تحتوي على قواعد معدلة - dihydrouridine (D-loop) و TψC triplet ، حيث y هي pseudouriain (T ^ C-loop). توجد حلقة إضافية بين فرعي أيتيكودون و T ^ C ، والتي تشمل 3-5 إلى 13-21 نيوكليوتيدات.
بشكل عام ، تتميز الأنواع المختلفة من الحمض النووي الريبي (tRNA) بثبات معين في تسلسل النوكليوتيدات ، والذي يتكون غالبًا من 76 نيوكليوتيد. يرجع الاختلاف في عددها بشكل أساسي إلى التغيير في عدد النيوكليوتيدات في الحلقة الإضافية. عادة ما يتم الحفاظ على المناطق التكميلية التي تدعم بنية الحمض النووي الريبي. يشكل الهيكل الأساسي للـ tRNA ، الذي يحدده تسلسل النيوكليوتيدات ، البنية الثانوية للـ tRNA ، والتي لها شكل ورقة البرسيم. في المقابل ، تحدد البنية الثانوية البنية الثلاثية الأبعاد ، والتي تتميز بتكوين حلزون مزدوج متعامد (الشكل 27). يتكون أحدهما من قبل المتقبل وفروع TψC ، والآخر بواسطة فرعي anticodon و D.
في نهاية أحد الحلزون المزدوج يوجد الحمض الأميني المنقول ، وفي نهاية الآخر يوجد anticodon. هذه المناطق هي الأبعد عن بعضها البعض. يتم الحفاظ على استقرار البنية الثلاثية للـ tRNA بسبب ظهور روابط هيدروجينية إضافية بين قواعد سلسلة polynucleotide ، الموجودة في أجزاء مختلفة منها ، ولكنها قريبة من الناحية المكانية في الهيكل الثالث.
أنواع مختلفة من الحمض الريبي النووي النقال لها نفس البنية الثلاثية ، على الرغم من وجود بعض الاختلافات.

الشكل 27. التنظيم المكاني للـ tRNA:
I - التركيب الثانوي للـ tRNA في شكل "ورقة البرسيم" ، يحددها هيكلها الأساسي (تسلسل النيوكليوتيدات في السلسلة) ؛
II - إسقاط ثنائي الأبعاد للهيكل الثلاثي للـ tRNA ؛
ثالثا - تخطيط جزيء الحمض الريبي النووي النقال في الفضاء
تتمثل إحدى ميزات الحمض النووي الريبي في وجود قواعد غير عادية فيه والتي تنشأ نتيجة التعديل الكيميائي بعد إدراج قاعدة عادية في سلسلة عديد النوكليوتيد. تحدد هذه القواعد المتغيرة التنوع الهيكلي الكبير للـ tRNAs في الخطة العامة لهيكلها. من الأهمية بمكان إجراء تعديلات على القواعد التي تشكل الكودون ، والتي تؤثر على خصوصية تفاعلها مع الكودون. على سبيل المثال ، الإينوزين الأساسي غير النمطي ، الذي يقف أحيانًا في الموضع الأول من الحمض الريبي النووي النقال المضاد ، قادر على الاندماج بشكل متكامل مع ثلاث قواعد ثالثة مختلفة لكودون الرنا المرسال - U و C و A (الشكل 3.28). نظرًا لأن إحدى ميزات الشفرة الجينية هي انحلالها (انظر القسم 3.4.1.2) ، يتم تشفير العديد من الأحماض الأمينية بعدة أكواد ، والتي ، كقاعدة عامة ، تختلف في قاعدتها الثالثة. نظرًا للارتباط غير المحدد لقاعدة anticodon المعدلة ، يتعرف الحمض الريبي النووي النقال واحد على العديد من الكودونات المترادفة.

الشكل 28. الرابطة الهيدروجينية للأينوزين مع ثلاث قواعد نيتروجينية مختلفة يشار إلى الروابط الهيدروجينية بالنقاط
تم أيضًا إثبات وجود عدة أنواع من الحمض الريبي النووي النقال (tRNAs) القادرة على الارتباط بنفس الكودون. نتيجة لذلك ، ليس 61 (بعدد الكودونات) ، ولكن تم العثور على حوالي 40 جزيءًا مختلفًا من الحمض الريبي النووي النقال في سيتوبلازم الخلايا. هذه الكمية كافية لنقل 20 نوعًا من الأحماض الأمينية المختلفة إلى موقع تجميع البروتين.
جنبًا إلى جنب مع وظيفة التعرف الدقيق على كودون معين في الرنا المرسال ، فإن جزيء الحمض الريبي النووي النقال يسلم حمضًا أمينيًا محددًا بدقة مشفرًا بهذا الكودون إلى موقع تخليق سلسلة الببتيد. يستمر الارتباط المحدد لـ tRNA مع "حمضه الأميني" على مرحلتين ويؤدي إلى تكوين مركب يسمى aminoacyl-tRNA (الشكل 29).

الشكل 29. إرفاق حمض أميني بالـ tRNA المقابل:
I - المرحلة الأولى ، تفاعل الأحماض الأمينية و ATP مع إطلاق بيروفوسفات ؛
II - المرحلة الثانية ، إرفاق الحمض الأميني الدهني بنهاية 3 بوصات من الحمض النووي الريبي
في المرحلة الأولى ، يتم تنشيط الحمض الأميني من خلال التفاعل مع مجموعة الكربوكسيل مع ATP. نتيجة لذلك ، يتم تكوين حمض أميني أديبيل.
في المرحلة الثانية ، يتفاعل هذا المركب مع مجموعة OH الموجودة في الطرف 3 بوصات من الحمض النووي الريبي المقابل ، ويربط الحمض الأميني مجموعة الكربوكسيل به ، ويطلق AMP. وهكذا ، تستمر هذه العملية مع إنفاق الطاقة التي تم الحصول عليها أثناء التحلل المائي لـ ATP إلى AMP.
تتحقق خصوصية الجمع بين الحمض الأميني والـ tRNA الذي يحمل المضاد المقابل بسبب خصائص إنزيم تركيبة aminoacyl-tRNA. في السيتوبلازم ، توجد مجموعة كاملة من هذه الإنزيمات القادرة على التعرف المكاني ، من ناحية ، على حمضها الأميني ، ومن ناحية أخرى ، المضاد tRNA المقابل (الشكل 3.30). المعلومات الوراثية ، "المسجلة" في جزيئات DNA و "المعاد كتابتها" في mRNA ، يتم فك شفرتها أثناء الترجمة نتيجة عمليتين للتعرف على الأسطح الجزيئية. أولاً ، يضمن إنزيم إنزيم aminoacyl-tRNA synthetase اتصال الحمض النووي الريبي (tRNA) بالحمض الأميني الذي ينقله. ثم يتزاوج aminoacyl-tRNA بشكل مكمل مع mRNA من خلال تفاعل anticodon-codon. بمساعدة نظام الحمض الريبي النووي النقال (tRNA) ، لغة سلسلة نوكليوتيدات الرنا المرسال. تُرجمت إلى لغة تسلسل الأحماض الأمينية للببتيد (الشكل 30).
RNA الريبوسوم (الرنا الريباسي). دورة الريبوسوم لتخليق البروتين. تتم عملية التفاعل بين mRNA و tRNA ، والتي تضمن ترجمة المعلومات من لغة النيوكليوتيدات إلى لغة الأحماض الأمينية ، على الريبوسومات. هذه الأخيرة عبارة عن مجمعات معقدة من الرنا الريباسي وبروتينات مختلفة ، حيث يشكل الأول سقالة. RNAs الريبوزومية ليست فقط مكونًا هيكليًا للريبوسومات ، ولكنها تضمن أيضًا ارتباطها بتسلسل معين من نوكليوتيدات الرنا المرسال. هذا يحدد إطار البداية والقراءة لتشكيل سلسلة الببتيد. بالإضافة إلى ذلك ، فإنها توفر التفاعل بين الريبوسوم و tRNA. تؤدي العديد من البروتينات التي تتكون منها الريبوسومات ، جنبًا إلى جنب مع الرنا الريباسي ، الأدوار الهيكلية والإنزيمية.

الشكل 30. مخطط ترجمة الشفرة الوراثية: I - ربط حمض أميني (التربتوفان) بالـ tRNA المقابل باستخدام إنزيم aminoacyl-tRNA synthetase ؛ II - ارتباط الحمض الريبي النووي النقال الذي يحمل الحمض الأميني الخاص به إلى الرنا المرسال بسبب ارتباط الأنتيكودون الخاص به بكودون الرنا المرسال
تتشابه ريبوسومات البروتينات وحقيقيات النوى في التركيب والوظيفة. تتكون من جزئين فرعيين: كبير وصغير. في حقيقيات النوى ، تتكون الوحدة الفرعية الصغيرة من جزيء واحد من الرنا الريباسي و 33 جزيء بروتين مختلف. تجمع الوحدة الفرعية الكبيرة بين ثلاثة جزيئات من الرنا الريباسي وحوالي 40 بروتينًا. تحتوي الريبوسومات بدائية النواة والريبوزومات الميتوكوندريا والبلاستيد على مكونات أقل.
الريبوسومات لها أخاديد. واحد منهم يحمل سلسلة عديد الببتيد المتنامية ، والآخر - mRNA. بالإضافة إلى ذلك ، يتم عزل اثنين من مواقع ربط الحمض النووي الريبي في الريبوسومات. يقع Aminoacyl-tRNA في aminoacyl ، موقع A ، ويحمل حمض أميني معين. في الببتيدل ، القسم P ، يوجد الحمض الريبي النووي النقال (tRNA) عادة ، والذي يتم تحميله بسلسلة من الأحماض الأمينية المتصلة بواسطة روابط الببتيد. يتم توفير تكوين مواقع A و P بواسطة كل من الوحدات الفرعية للريبوسوم.
في كل لحظة ، يحمي الريبوسوم قطعة من الرنا المرسال يبلغ طولها حوالي 30 نيوكليوتيد. هذا يضمن تفاعل اثنين فقط من الحمض الريبي النووي النقال مع كودونين متجاورين من الرنا المرسال (الشكل 31).
يتم التعبير عن ترجمة المعلومات إلى "لغة" الأحماض الأمينية في التراكم التدريجي لسلسلة الببتيد وفقًا للتعليمات الواردة في الرنا المرسال. تحدث هذه العملية على الريبوسومات ، والتي توفر التسلسل لفك تشفير المعلومات باستخدام الحمض الريبي النووي النقال. يمكن تمييز ثلاث مراحل أثناء الترجمة: بدء واستطالة وإنهاء تخليق سلسلة الببتيد.

الشكل 31. مواقع الربط لجزيئات الحمض الريبي النووي النقال والريبوسوم:
الأول - الريبوسوم غير المحمل ، والثاني - الريبوسوم المحمل ؛ ak - حمض أميني
تتكون مرحلة البدء ، أو بداية تخليق الببتيد ، من الجمع بين جسيمين فرعيين من الريبوسوم تم فصلهما مسبقًا في السيتوبلازم في موقع معين من الرنا المرسال وربط أول aminoacyl-tRNA به. يحدد هذا أيضًا الإطار لقراءة المعلومات الواردة في mRNA (الشكل 32).
في جزيء أي mRNA ، بالقرب من نهايته 5 بوصات ، يوجد موقع مكمل للرنا الريباسي للوحدة الفرعية الصغيرة للريبوسوم والذي يتعرف عليه تحديدًا. وبجانبه يوجد كودون البداية AUT ، والذي يقوم بترميز amino الميثيونين الحمضي. تتصل الوحدة الفرعية الصغيرة للريبوسوم بـ mRNA بطريقة تجعل كود البدء AUT يقع في المنطقة المقابلة لموقع P- وفي نفس الوقت ، فقط الحمض الريبي النووي النقال البادئ الذي يحمل الميثيونين هو القادر على أخذ ضع في القسم P غير المكتمل للوحدة الفرعية الصغيرة والاتصال التكميلي بكودون البداية. بعد الحدث الموصوف ، تتحد الوحدات الفرعية الكبيرة والصغيرة من الريبوسوم لتشكل مؤامرات peptidyl و aminoacyl (الشكل 3.32).

الشكل 32. الشروع في تخليق البروتين:
أنا - اتصال فرعي صغير من الريبوسوم مع mRNA ، والتعلق بكودون بدء الحمض الريبي النووي النقال الذي يحمل الميثيونين ، والذي يقع في القسم P غير المكتمل ؛ II - اتصال الجسيمات الفرعية الكبيرة والصغيرة من الريبوسوم بتكوين مواقع P - و A ؛ ترتبط المرحلة التالية بالتنسيب في الموقع A من aminoacyl-tRNA المقابل لكودون mRNA الموجود فيه ، بداية الاستطالة ؛ ak - حمض أميني
بنهاية مرحلة البدء ، يشغل موقع P بواسطة aminoacyl-tRNA المرتبط بالميثيونين ، بينما يقع موقع A للريبوسوم بجوار كودون البدء.
يتم تحفيز العمليات الموصوفة لبدء الترجمة بواسطة بروتينات خاصة - عوامل بدء ، والتي ترتبط بشكل متحرك بوحدة فرعية صغيرة من الريبوسوم. عند الانتهاء من مرحلة البدء وتشكيل مجمع aminoacyl-tRNA الذي يبدأ الريبوسوم ، يتم فصل هذه العوامل عن الريبوسوم.
تشتمل مرحلة الاستطالة ، أو استطالة الببتيد ، على جميع التفاعلات من تكوين الرابطة الببتيدية الأولى إلى ارتباط آخر حمض أميني. إنه حدث متكرر دوريًا حيث يوجد اعتراف محدد بالكودون التالي aminoacyl-tRNA الموجود في الموقع A ، وهو تفاعل تكميلي بين anticodon و codon.
نظرًا لخصائص التنظيم ثلاثي الأبعاد لـ tRNA عندما يكون anticodon متصلاً بكودون mRNA. يقع الحمض الأميني المنقول بواسطته في الموقع A ، بالقرب من الأحماض الأمينية المدرجة سابقًا والموجودة في موقع P. تتكون رابطة الببتيد بين اثنين من الأحماض الأمينية ، يتم تحفيزهما بواسطة بروتينات خاصة تشكل الريبوسوم. نتيجة لذلك ، يفقد الحمض الأميني السابق ارتباطه بـ tRNA الخاص به وينضم إلى aminoacyl-tRNA الموجود في الموقع A. يتم تحرير الحمض الريبي النووي النقال الموجود في هذه اللحظة في موقع P ويذهب إلى السيتوبلازم (الشكل 33). تترافق حركة الحمض الريبي النووي النقال المحملة بسلسلة ببتيدية من الموقع A إلى موقع P مع تقدم الريبوسوم على طول mRNA بخطوة تقابل كودون واحد. الآن يتلامس الكودون التالي مع الموقع A ، حيث سيتم "التعرف عليه" على وجه التحديد بواسطة aminoacyl-tRNA المقابل ، والذي سيضع الحمض الأميني الخاص به هناك. يتكرر تسلسل الأحداث هذا حتى يتلقى الموقع A للريبوسوم كودونًا نهائيًا لا يوجد له الحمض الريبي النووي النقال المقابل.

الشكل 33. مرحلة الاستطالة في تخليق البروتين:
المرحلة الأولى - ينضم aminoacyl-tRNA إلى الكودون الموجود في الموقع A ؛
المرحلة الثانية - بين الأحماض الأمينية الموجودة في المواقع A و P ، يتم تكوين رابطة ببتيدية: يتم تحرير الحمض النووي الريبي الموجود في موقع P من الحمض الأميني ويترك الريبوسوم ؛
المرحلة الثالثة - يتحرك الريبوسوم على طول الرنا المرسال بواسطة كودون واحد بحيث ينتقل الحمض النووي الريبي المحمّل بسلسلة الببتيد من الموقع A إلى الموقع P. يمكن احتلال موقع A المجاني بواسطة aminoacyl-tRNA المقابل
الشكل 34. إنهاء تخليق سلسلة الببتيد:
المرحلة الأولى - ربط عامل التحرير بكودون الإيقاف ؛
المرحلة الثانية - الإنهاء ، إطلاق الببتيد المكتمل ؛
المرحلة الثالثة - تفكك الريبوسوم إلى جزئين فرعيين
يتم إجراء تجميع سلسلة الببتيد بمعدل مرتفع إلى حد ما ، اعتمادًا على درجة الحرارة. في البكتيريا عند 37 درجة مئوية ، يتم التعبير عنها على أنها إضافة 12 إلى 17 حمض أميني لكل ثانية واحدة إلى الببتيد الفرعي. في الخلايا حقيقية النواة ، يكون هذا المعدل أقل ويتم التعبير عنه بإضافة اثنين من الأحماض الأمينية في 1 ثانية.
ترتبط مرحلة الإنهاء ، أو اكتمال تخليق عديد الببتيد ، بالتعرف على بروتين ريبوسومي معين لأحد أكواد الإنهاء (UAA أو UAG أو UGA) عندما يدخل منطقة موقع A للريبوسوم. في هذه الحالة ، يتم توصيل الماء بآخر حمض أميني في سلسلة الببتيد ، ويتم فصل نهايته الكربوكسيلية عن الحمض الريبي النووي النقال. نتيجة لذلك ، تفقد سلسلة الببتيد المكتملة ارتباطها بالريبوسوم ، الذي ينقسم إلى جزئين فرعيين (الشكل 34).
4.3.2 سمات التنظيم والتعبير المعلومات الجينية في حقيقيات النوى و pro-
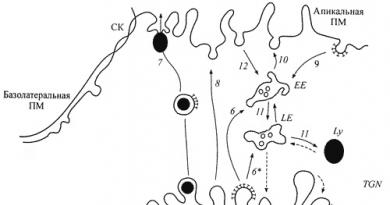
وفقًا للتنظيم الكيميائي لمواد الوراثة والتنوع ، لا تختلف الخلايا حقيقية النواة وبدائية النواة عن بعضها البعض بشكل أساسي. يتم تمثيل مادتهم الجينية بواسطة الحمض النووي. المشترك بينهم هو مبدأ تسجيل المعلومات الجينية ، وكذلك الكود الجيني. يتم تشفير نفس الأحماض الأمينية في الخلايا الأولية وحقيقيات النوى بنفس الكودونات. من حيث المبدأ ، يتم استخدام المعلومات الوراثية المخزنة في الحمض النووي بنفس الطريقة في هذه الأنواع من الخلايا. أولاً ، يتم نسخها في تسلسل النوكليوتيدات لجزيء الرنا المرسال ، ثم تُترجم إلى تسلسل الأحماض الأمينية للببتيد على الريبوسومات بمشاركة الحمض النووي الريبي. ومع ذلك ، فإن بعض سمات تنظيم المادة الوراثية ، والتي تميز الخلايا حقيقية النواة عن تلك بدائية النواة ، تسبب اختلافات في استخدام معلوماتها الجينية.
توجد المادة الوراثية لخلية بدائية النواة بشكل أساسي في جزيء DNA دائري واحد. يقع مباشرة في سيتوبلازم الخلية ، حيث توجد أيضًا الحمض النووي الريبي والإنزيمات اللازمة للتعبير الجيني ، وبعضها موجود في الريبوسومات. تتكون الجينات بدائية النواة بالكامل من ترميز متواليات النوكليوتيدات التي تتحقق أثناء تخليق البروتينات أو الحمض الريبي النووي النقال أو الرنا الريباسي.
المادة الوراثية من حقيقيات النوى أكبر في الحجم من تلك الموجودة في بدائيات النوى. يقع بشكل أساسي في الهياكل النووية الخاصة - الكروموسومات ، التي يتم فصلها عن السيتوبلازم بواسطة الغلاف النووي. يقع الجهاز الضروري لتخليق البروتين ، المكون من الريبوسومات ، الحمض الريبي النووي النقال ، ومجموعة من الأحماض الأمينية والإنزيمات ، في سيتوبلازم الخلية.
توجد اختلافات كبيرة في التنظيم الجزيئي للجينات في الخلايا حقيقية النواة. في معظمها ، يتم مقاطعة تسلسلات تشفير exon بواسطة مناطق intron التي لا تُستخدم في تخليق tRNA أو rRNA أو الببتيدات. يختلف عدد هذه المناطق باختلاف الجينات. لقد ثبت أن جين بيضوي الدجاج يشتمل على 7 إنترونات ، وجين البروكولاجين في الثدييات - 50. تتم إزالة هذه المناطق من الحمض النووي الريبي المنسوخ الأساسي ، وبالتالي فإن استخدام المعلومات الجينية في خلية حقيقية النواة يحدث بشكل مختلف نوعًا ما. في خلية بدائية النواة ، حيث لا يتم فصل المادة الوراثية وجهاز التخليق الحيوي للبروتين مكانيًا ، يحدث النسخ والترجمة في وقت واحد تقريبًا. في خلية حقيقية النواة ، لا يتم فصل هاتين المرحلتين مكانيًا فقط بواسطة الغلاف النووي ، ولكن يتم فصلهما أيضًا بمرور الوقت عن طريق عمليات نضج الرنا المرسال ، والتي يجب إزالة التسلسلات غير المعلوماتية منها (الشكل 35).

أرز. 35. مخطط معمم لعملية التعبير عن المعلومات الجينية في خلية حقيقية النواة
بالإضافة إلى هذه الاختلافات في كل مرحلة من مراحل التعبير عن المعلومات الجينية ، يمكن ملاحظة بعض سمات مسار هذه العمليات في الكائنات الأولية وحقيقيات النوى.
النسخ في المؤيدة وحقيقيات النوى. النسخ هو توليف الحمض النووي الريبي على قالب الحمض النووي. في بدائيات النوى ، يتم تحفيز تخليق جميع الأنواع الثلاثة من الحمض النووي الريبي بواسطة مركب بروتيني معقد واحد - RNA polymerase.
يشتمل جهاز النسخ للخلايا حقيقية النواة على ثلاثة بوليميرات من الحمض النووي الريبي النووي ، بالإضافة إلى بوليميرات الحمض النووي الريبي الميتوكوندريا والبلاستيد. تم العثور على بوليميريز RNA في نوى الخلايا وهو مسؤول عن نسخ جينات الرنا الريباسي. يقع RNA polymerase II في النسغ النووي وهو مسؤول عن تخليق سلائف الرنا المرسال. RNA polymerase III هو جزء صغير موجود في النسغ النووي ويشارك في تخليق rRNAs الصغيرة و tRNAs. يحتوي كل من هذه الإنزيمات على وحدتين فرعيتين كبيرتين وما يصل إلى 10 وحدات صغيرة. تختلف بوليميرات الحمض النووي الريبي للميتوكوندريا والبلاستيدات عن تلك النووية.
يتعرف مركب إنزيم بوليميراز الحمض النووي الريبي على وجه التحديد على تسلسل نوكليوتيد معين (غالبًا أكثر من واحد) يقع على مسافة معينة من نقطة بداية النسخ - المروج. نقطة البداية هي نيوكليوتيد الحمض النووي الذي يتوافق مع النيوكليوتيدات الأولى المضمنة في الإنزيم الموجود في نسخة الحمض النووي الريبي.
في بدائيات النوى ، عادةً ليست بعيدة عن نقطة البداية في مقابل مسار النسخ هي سلسلة من ستة نيوكليوتيدات - TATAAT ، تسمى كتلة Pribnow. هذا تسلسل متوسط يتكون من القواعد الأكثر شيوعًا ، وأكثرها تحفظًا هي القواعد الأولى والثانية والسادسة. من الواضح أن الوجود في هذا التسلسل من القواعد ، المرتبط في الغالب بواسطة روابط هيدروجينية مزدوجة مع قواعد تكميلية لخيط آخر ، يسهل الذوبان المحلي للحلزون المزدوج للحمض النووي وتشكيل منطقتين منفصلتين عند ملامسته لبوليميراز الحمض النووي الريبي. تقع كتلة Pribnov في الموضع من - 11 إلى - 5 أو من - 14 إلى - 8 ، أي. عدد قليل من النيوكليوتيدات قبل نقطة بداية النسخ (الشكل 36). عند اكتشاف هذا التسلسل ، يرتبط بوليميراز الحمض النووي الريبي به بشدة ويبدأ في تخليق الحمض النووي الريبي. دور مهم بنفس القدر في إقامة اتصال بين بوليميراز الحمض النووي الريبي والحمض النووي ينتمي إلى تسلسل نيوكليوتيد آخر ، مركزه في الموضع - 35. يطلق عليه منطقة التعرف - TTGACA. بين المنطقتين المشار إليهما ، تكون المسافة ثابتة تمامًا وتتراوح من 16 إلى 19 زوجًا أساسيًا (bp).
تتضمن محفزات الجينات حقيقية النواة أيضًا ما لا يقل عن اثنين من تسلسل النيوكليوتيدات المحدد المتمركز عند -25 نقطة أساس و -75 نقطة أساس.
على مسافة 19-27 نيوكليوتيدات من نقطة البداية مقابل مسار النسخ في العديد من جينات حقيقية النواة ، تم العثور على متوسط التسلسل الإحصائي TAT ATAAT (كتلة TATA ، أو كتلة Hogness) ، حيث ، كما في كتلة Pribnow في بدائيات النوى ، تسود القواعد وتشكل روابط أضعف. يُشار إلى التسلسل الثاني ، الموجود في العديد من محفزات حقيقيات النوى ويتكون من GG C T CAATCT ، باسم كتلة CAAT. تحتل موقعًا بين -70 و -80 نيوكليوتيد وهي أيضًا المنطقة التي يتعرف عليها البوليميراز. في بعض الجينات ، تم العثور على محفزات متعددة المكونات.
وبالتالي ، في الجينات الفردية لفيروس الهربس ، يلزم وجود ثلاثة تسلسلات DNA لبدء النسخ الفعال ، وتقع بين -19 و -27 ، وبين -47 و -61 ، وأيضًا بين -80 و -105 نيوكليوتيدات.

الشكل 36. نقاط الاتصال لبوليميراز الحمض النووي الريبي الموجودة في الشريط العلوي من الحمض النووي (المروج)
تشير ميزات مناطق المروج إلى أنه ليس فقط مجموعة القواعد في مناطق معينة من المروج مهمًا لبدء النسخ ، ولكن أيضًا الموضع النسبي في جزيء الحمض النووي لهذه المناطق ، والذي يرتبط به مجمع إنزيم بوليميريز RNA.
بعد إنشاء اتصال بين بوليميراز الحمض النووي الريبي وموقع المروج ، يبدأ تجميع جزيء الحمض النووي الريبي ، والذي يتضمن غالبًا أول نيوكليوتيد يحمل قاعدة بيورين (عادةً أدينين) ويحتوي على ثلاث بقايا 5-فوسفات.
علاوة على ذلك ، عندما يتحرك RNA polymerase على طول جزيء DNA ، يحدث استطالة تدريجية لسلسلة RNA ، والتي تستمر حتى يواجه الإنزيم منطقة النهاية. المنهي هو الموقع الذي يتوقف فيه النمو الإضافي لسلسلة الحمض النووي الريبي ويتم تحريره من قالب الحمض النووي. يتم فصل RNA polymerase أيضًا عن الحمض النووي ، والذي يعيد بناء هيكله المزدوج الشريطة.

الشكل 37. منطقة من الحمض النووي ذات تناظر مزدوج - متناظرة:
أنا - متناظرة ، حيث يوجد تسلسل هو نفسه عند القراءة في اتجاهين متعاكسين ؛
II - متناظر يكون فيه التكرار المظلل المقلوب على مسافة من محور التناظر
في الخلايا بدائية النواة ، تحتوي المُنتهي بالضرورة على متناظرات - متواليات مزدوجة الشريطة من نيوكليوتيدات الحمض النووي التي تقرأ بالتساوي في كلا الاتجاهين (الشكل 37). إن منطقة الحمض النووي الريبي المنسوخة من مثل هذا التسلسل قادرة على تكوين دبابيس شعر مزدوجة السلسلة بسبب الاقتران التكميلي للنيوكليوتيدات المتناظرة. ربما تكون هذه هي إشارة إتمام النسخ ، التي يتعرف عليها بوليميراز الرنا (الشكل 3.38). يبدو أن دبابيس الشعر الناتجة توقف البوليميراز عند الطرف النهائي. بعد منعطف الشعر ، يشتمل جزيء الحمض النووي الريبي على سلسلة من النيوكليوتيدات التي تحتوي على اليوراسيل (بوليو) ، والتي ربما تشارك في إطلاق الحمض النووي الريبي من قالب الحمض النووي. في الواقع ، يتميز تسلسل polyU RNA المرتبط بتسلسل DNA متعدد الأدينيل (polyA) بتفاعل ضعيف. من الجدير بالذكر أن منطقة الحمض النووي الغنية بأزواج A-T توجد ليس فقط في موقع بدء النسخ (كتلة Pribnov) ، ولكن أيضًا في منطقة المنهي.
تختلف المواد النهائية البكتيرية بشكل كبير في فعاليتها. بعضها ، إذا جاز التعبير ، لم يتم ملاحظته بواسطة بوليميراز الحمض النووي الريبي ، ويستمر النسخ خارج الفاصل. يتم ملاحظة مثل هذه القراءة للنهاية أثناء نسخ الجينات البكتيرية كنتيجة لمنع الإنهاء بواسطة بروتينات معينة - عوامل مضادة للانتهاء. نتيجة منع الإنهاء هي تخليق مرنا متعدد الكريات ، والذي يتضمن معلومات مشطوبة من عدة جينات هيكلية متعاقبة.
تمت دراسة مُنهي الجينات حقيقية النواة بدرجة أقل من تلك الموجودة في بدائيات النوى ، ولكنها تحتوي أيضًا على مناطق غنية بأزواج G-C المتصلة بواسطة روابط هيدروجينية ثلاثية ، حيث يوجد موقع به أزواج من A-T. في هذا الموقع ، يشتمل النص على تسلسل متعدد الوحدات يتفاعل بشكل ضعيف مع منطقة قالب polyA للحمض النووي.
من الممكن أن تلعب منطقة النهاية ، الغنية بأزواج G-C ، دورًا معينًا في إيقاف بوليميريز الحمض النووي الريبي ، وتضمن منطقة RNA التي تحتوي على UUUU فصل النسخة عن قالب DNA.
في حقيقيات النوى ، لم يتم العثور على تكوين هياكل مشابهة لدبابيس الشعر في الحمض النووي الريبي بدائية النواة. لذلك ، كيف يحدث إنهاء النسخ فيها لا يزال غير واضح.
تحتوي جميع الرنا المرسال على مناطق ترميز تمثل مجموعة من الكودونات التي تشفر تسلسل الأحماض الأمينية في الببتيد. كقاعدة عامة ، تبدأ هذه المناطق برمز البدء AUG ، ولكن في بعض الأحيان يتم استخدام كود GUT في البكتيريا. في نهاية تسلسل التشفير يوجد رمز إنهاء. بالإضافة إلى مناطق التشفير في الرنا المرسال ، يمكن وضع تسلسلات إضافية في كلا الطرفين. في الطرف 5 ، هذه هي المنطقة الرائدة ، وتقع قبل كود البداية. في نهاية 3 ، هناك مقطورة تتبع كودون الإنهاء.

الشكل 38. تكوين دبوس الشعر بواسطة منطقة الحمض النووي الريبي أثناء إنهاء النسخ في بدائيات النوى
تشكل منطقة الحمض النووي الريبي الحاملة للون المتناظر بنية اقتران تكميلية - دبوس شعر (التكرارات المقلوبة مظللة)
في الرنا المرسال متعدد الكريات من بدائيات النوى ، هناك مناطق بين مناطق الترميز ، والتي تختلف في الحجم (الشكل 3.39).

الشكل 39. RNA رسول متعدد الخلايا من بدائيات النوى:
1 - مناطق غير مشفرة ، 2 - مناطق بينية ، 3 - مناطق مشفرة ، 4 - أكواد إنهاء
نظرًا لحقيقة أن الجينات بدائية النواة تتكون بالكامل من متواليات النيوكليوتيدات المتضمنة في تشفير المعلومات ، فإن الحمض النووي الريبي المنسوخ منها فورًا بعد تركيبها يكون قادرًا على العمل كقوالب للترجمة. فقط في حالات استثنائية هو النضج الأولي المطلوب - المعالجة.
على عكس الجينات بدائية النواة ، فإن معظم جينات الخلايا حقيقية النواة تكون متقطعة ، لأنها تحمل في تكوينها تسلسلات نيوكليوتيد غير مفيدة - إنترونات لا تشارك في ترميز المعلومات. في هذا الصدد ، تكون النصوص الأولية التي تم تصنيعها بواسطة RNA polymerase II أكبر من اللازم للترجمة وأقل استقرارًا. يشكلون معًا ما يسمى بـ RNA النووي غير المتجانسة (tRNA) ، والذي يخضع للمعالجة ويتحول إلى mRNA ناضج قبل أن يغادر النواة ويبدأ العمل بنشاط في السيتوبلازم.
معالجة mRNA حقيقية النواة. يتضمن نضج mRNA أو معالجته تعديل النسخة الأولية وإزالة مناطق intron غير المشفرة منه ، متبوعًا بضم (الربط) لتسلسلات الترميز - exons. يبدأ تعديل النسخة الأولية من الرنا المرسال حقيقية النواة بعد فترة وجيزة من تخليق نهايته 5 بوصات التي تحتوي على إحدى قواعد البيورين (الأدينين أو الجوانين). يتم تشكيل غطاء في هذه النهاية ، والذي يمنع الطرف 5 بوصات من الرنا المرسال من خلال الارتباط بـ النوكليوتيدات الأولى لنسخة ثلاثي الفوسفونوكليوسيد تحتوي على الجوانين ، السندات 5 "-5".
Gfff + fffAfN… → GfffAfN. + ff + f نتيجة لذلك ، يتم تكوين تسلسل GfffAfFM ... ، حيث تكون بقايا التوانين في الاتجاه العكسي بالنسبة إلى نيوكليوتيدات الرنا المرسال الأخرى. يتضمن تعديل الطرف الخامس من الرنا المرسال أيضًا مثيلة للجوانين المرفق وأول قاعدتين أو ثلاث قواعد للنسخة الأولية (الشكل 3.40). وتضمن الأغطية المتكونة في أطراف الرنا المرسال مقاس 5 بوصات التعرف على جزيئات الرنا المرسال بواسطة جزيئات فرعية صغيرة من الريبوسومات في السيتوبلازم. يتم إجراء التخزين المؤقت حتى قبل نهاية توليف النص الأساسي.

أرز. 40. تكوين mRNA ناضجة حقيقية النواة أثناء المعالجة:
1 - متواليات غير مشفرة ، 2 - إكسونات ، 3 - إنترونات ، 4 - كودون فاصل
بعد اكتمال النسخ ، تتم إزالة جزء من النيوكليوتيدات في الطرف 3 بوصات من النسخة الأولية ويتم إرفاق تسلسل يتكون من 100-200 من بقايا حمض الأدينيل (بولي أ) (الشكل 3.40). ويعتقد أن هذا يساهم التسلسل في زيادة معالجة ونقل mRNA الناضج من النواة بعد إطلاق mRNA في السيتوبلازم ، يتم تقصير تسلسل polyA الخاص به تدريجيًا تحت تأثير الإنزيمات التي تشق النيوكليوتيدات في النهاية 3. وبالتالي ، يمكن لطول تسلسل polyA أن يحكم بشكل غير مباشر على وقت مكوث mRNA في السيتوبلازم. من المحتمل أن تؤدي إضافة تسلسل polyA أثناء المعالجة إلى تعزيز استقرار mRNA. ومع ذلك ، لا يحتوي حوالي ثلث الرنا المرسال على موقع بولي أ على الإطلاق. وتشمل هذه ، على سبيل المثال ، هيستون mRNAs.
إن تكوين غطاء عند الطرف 5 'وتسلسل polyA في الطرف 3' هو خاصية مميزة فقط لمعالجة RNA المركب بواسطة RNA polymerase II. بالإضافة إلى المثيلة أثناء تكوين أغطية في mRNA لحقيقيات النوى الأعلى ، تحدث مثيلة جزء صغير من النيوكليوتيدات الداخلية بتردد واحد تقريبًا لكل ألف قاعدة من mRNA.
إلى جانب تعديل mRNA حقيقية النواة ، تتضمن المعالجة الإزالة من النسخ الأولية لمناطق الإنترون غير المفيدة لبروتين معين ، يتراوح حجمه من 100 إلى 10000 نيوكليوتيد أو أكثر. تمثل الإنترونات حوالي 80٪ من كل hnRNA. يُطلق على إزالة الإنترونات التي يتبعها الانضمام إلى المناطق الخارجية اسم التضفير (الشكل 40).
الربط هو آلية يجب أن تضمن إزالة مناطق intron المحددة جيدًا من النسخة الأولية. يمكن أن يؤدي انتهاك هذه العملية إلى تحول في إطار القراءة أثناء الترجمة واستحالة تصنيع ببتيد عادي. يبدو أن انتظام استئصال الإنترونات مضمون من خلال وجود متواليات نوكليوتيد محددة في نهاياتها ، والتي تعمل كإشارات للتضفير.
تم الآن وصف العديد من آليات الربط المعقولة لضمان دقة هذه العملية. ربما يتم تحقيق ذلك من خلال عمل بعض الإنزيمات التي تتعرف على وجه التحديد على الأقسام الطرفية للإنترونات وتحفز تكسير روابط الفوسفوديستر عند حدود exon-intron ، ثم تكوين روابط بين اثنين من exons.
تم إنشاء مشاركة نشطة في تضفير الرنا النووي الصغير الخاص (snRNAs) الذي يشكل مجمعات مع البروتينات (snRNPs). من الواضح أن snRNAs تتفاعل بشكل متكامل مع متواليات النيوكليوتيدات الخاصة بها مع المناطق الطرفية للإنترونات ، والتي تشكل حلقات مغلقة. يؤدي انشقاق الحمض النووي الريبي في فم حلقة intron إلى إزالة تسلسل غير إعلامي وربط (الربط) لنهايات exon المجاورة.
كما تمت مناقشة القدرة التحفيزية التلقائية لنسخة RNA للربط. تشير طرق التضفير الموصوفة إلى عدم وجود آلية عالمية لهذه العملية ، ومع ذلك ، في جميع الحالات ، يتم تحقيق الإزالة الدقيقة للإنترونات من خلال تكوين مرنا محدد يوفر تخليق البروتين اللازم للخلية.
في الوقت الحاضر ، تم إثبات إمكانية التضفير البديل (الحصري المتبادل) ، حيث يمكن حذف متواليات النيوكليوتيدات المختلفة من نفس النسخة الأولية ويمكن تشكيل mRNAs ناضجة مختلفة. نتيجة لذلك ، يمكن أن يعمل نفس تسلسل نيوكليوتيدات الحمض النووي كمعلومات لتخليق الببتيدات المختلفة. من المحتمل أن يكون التضفير البديل نموذجيًا جدًا في نظام الجين المناعي للثدييات ، حيث يسمح بتكوين الرنا المرسال استنادًا إلى نسخة واحدة لتخليق أنواع مختلفة من الأجسام المضادة.
نظرًا للتحولات التي تحدث مع نسخة RNA أثناء المعالجة ، فإن mRNAs الناضجة حقيقية النواة أكثر استقرارًا من mRNAs بدائية النواة.
عند الانتهاء من المعالجة ، يتم اختيار mRNA الناضج قبل دخول السيتوبلازم ، حيث يدخل 5٪ فقط من hnRNA. يتم تقسيم الباقي دون مغادرة النواة.
وبالتالي ، فإن التحولات في النسخ الأولية للجينات حقيقية النواة ، بسبب تنظيمها الخارجي والحاجة إلى نقل mRNA من النواة إلى السيتوبلازم ، تحدد ميزات تنفيذ المعلومات الجينية في خلية حقيقية النواة.
الترجمة في المؤيدة وحقيقيات النوى. في الخلايا بدائية النواة ، ترتبط عملية الترجمة بتركيب الرنا المرسال: تحدث في وقت واحد تقريبًا. إلى حد كبير ، هذا يرجع إلى هشاشة mRNA البكتيرية ، والتي تتحلل بسرعة. تتجلى العلاقة بين النسخ والترجمة في البكتيريا في اتساق معدلات هذه العمليات. عند 37 درجة مئوية ، يستمر النسخ بمعدل 2500 نيوكليوتيد / دقيقة (14 كودون / ثانية) ، وتحدث الترجمة بمعدل 15 حمض أميني / ثانية.
تبدأ الترجمة في بدائيات النوى بعد فترة وجيزة من تكوين الطرف الخامس من الرنا المرسال ، قبل انتهاء تركيبها. ونتيجة لذلك ، بعد بوليميريز الحمض النووي الريبي ، تتحرك الريبوسومات على طول الرنا المرسال ، وتجمع سلاسل الببتيد (الشكل 41). بعد بعض الوقت من البداية من النسخ (حوالي دقيقة واحدة) وقبل الانتهاء من ترجمة الطرف الثالث للقالب ، يبدأ تدهور نهايته 5. نظرًا لحقيقة أن عمر mRNAs المختلفة ليس هو نفسه ، فإن مقدار يختلف البروتين المركب في قوالب مختلفة.
تتمثل إحدى ميزات الترجمة في بدائيات النوى في التضمين في سلسلة الببتيد كأول حمض أميني لميثيونين - فورميل ميثيونين المعدل ، والذي تبدأ منه جميع الببتيدات المصنعة حديثًا. حتى في حالة تنفيذ دور كود البدء بواسطة الكود GUG ، الذي يشفر فالين في ظل الظروف العادية ، يظهر فورميل ميثيونين في الموضع الأول من الببتيد. يتبع كود البدء AUG أو GUG الموقع الرائد ، المحمي بالريبوسوم في وقت بدء الترجمة.
يرجع اتصال الريبوسوم مع الرنا المرسال إلى التفاعل التكميلي للنيوكليوتيدات لإحدى الرنا الريباسي مع تسلسل النيوكليوتيدات لزعيم الرنا المرسال.
يقع هذا التسلسل (Shine-Dalgarno) من 4 إلى 7 قواعد قبل كودون AUG ويوجد في كل مكان في المناطق الرائدة في بدائيات النوى.
عندما يتم توصيل الطرف 5'-end من mRNA بالوحدة الفرعية الصغيرة للريبوسوم ، يظهر كودون البداية تقريبًا في منتصف جزء mRNA المحمي بواسطة الريبوسوم ، في المنطقة المقابلة لموقع P الخاص به.
في حقيقيات النوى ، تحدث الترجمة في السيتوبلازم ، حيث يدخل mRNA الناضج من النواة. يتم التعرف على نهاية mRNA المنسوخة بواسطة الوحدة الفرعية الصغيرة للريبوسوم ، ثم يتفاعل التسلسل الرئيسي ، الذي يحتوي على ما يصل إلى 100 نيوكليوتيد ، مع الرنا الريباسي. في هذه الحالة ، يكون كودون البدء AUG في موقع P غير المكتمل للريبوسوم. بعد ربط aminoacyl-tRNA الحامل للميثيونين بكودون البدء ، يتم لم شمل وحدتين فرعيتين من الريبوسوم وتشكيل مواقعها A و P. يتم الانتهاء من تخليق البروتين في خلية حقيقية النواة ، والذي يتم إجراؤه على mRNA أحادي النواة ، بعد مرور الريبوسوم عبر الرنا المرسال بأكمله ، حتى يتعرف على كودون الإنهاء الذي يوقف تكوين روابط الببتيد.
التحولات اللاحقة للترجمة للبروتينات. سلاسل الببتيد التي يتم تصنيعها أثناء الترجمة ، على أساس هيكلها الأساسي ، تكتسب ثانويًا وثالثًا ، والعديد أيضًا منظمة رباعي تتكون من العديد من سلاسل الببتيد. اعتمادًا على الوظائف التي تؤديها البروتينات ، يمكن أن تخضع تسلسلها من الأحماض الأمينية لتحولات مختلفة ، وتشكل جزيئات بروتينية نشطة وظيفيًا.
يتم تصنيع العديد من بروتينات الغشاء كبروتينات أولية مع تسلسل رئيسي في الطرف N الذي يوفر له التعرف على الغشاء. يتم قطع هذا التسلسل أثناء النضج ودمج البروتين في الغشاء. تحتوي البروتينات الإفرازية أيضًا على تسلسل قيادي عند الطرف N يضمن نقلها عبر الغشاء. تحمل بعض البروتينات ، بعد الترجمة مباشرة ، مزايا إضافية للأحماض الأمينية تحدد ثبات سلائف البروتين النشط. أثناء نضوج البروتين ، يتم إزالتها ، مما يسمح بنقل البروتين غير النشط إلى البروتين النشط. على سبيل المثال ، يتم تصنيع الأنسولين مبدئيًا على شكل بريبرونسولين. أثناء الإفراز ، يتم قطع التسلسل المسبق ، ثم يخضع proinsulin لتعديل يتم فيه إزالة جزء من السلسلة منه ويتحول إلى أنسولين ناضج.

الشكل 41. النسخ والترجمة وتدهور الرنا المرسال في بدائيات النوى:
يرتبط I - RNA polymerase بالحمض النووي ويبدأ في تخليق mRNA في الاتجاه 5 "→ 3" ؛
II - مع تقدم بوليميراز RNA ، يتم ربط الريبوسومات بنهاية 5 'من mRNA ، بدء تخليق البروتين ؛
ثالثًا - مجموعة من الريبوسومات تتبع بوليميريز الحمض النووي الريبي ، ويبدأ تحللها في نهاية 5 'من الرنا المرسال ؛
رابعًا - عملية التحلل أبطأ من النسخ والترجمة ؛
V - بعد نهاية النسخ ، يتم تحرير الرنا المرسال من الحمض النووي ، وتستمر الترجمة والتحلل في الطرف الخامس على ذلك
بتشكيل منظمة ثلاثية ورباعية في سياق التحولات اللاحقة للترجمة ، تكتسب البروتينات القدرة على العمل بنشاط ، ويتم تضمينها في بعض الهياكل الخلوية وأداء الوظائف الأنزيمية وغيرها.
تكشف السمات المدروسة لتنفيذ المعلومات الجينية في الخلايا الأولية وحقيقية النواة عن التشابه الأساسي لهذه العمليات. وبالتالي ، فإن آلية التعبير الجيني المرتبطة بالنسخ والترجمة اللاحقة للمعلومات المشفرة بمساعدة رمز بيولوجي قد تطورت ككل حتى قبل تشكيل هذين النوعين من التنظيم الخلوي. أدى التطور المتباين لجينومات الكائنات الأولية وحقيقيات النوى إلى اختلافات في تنظيم مادتها الوراثية ، والتي لا يمكن إلا أن تؤثر على آليات التعبير عنها.
إن التحسين المستمر لمعرفتنا حول تنظيم وعمل مادة الوراثة والتنوع يحدد تطور الأفكار حول الجين كوحدة وظيفية لهذه المادة.
على اليمين يوجد أكبر حلزون للحمض النووي البشري تم بناؤه من أشخاص على الشاطئ في فارنا (بلغاريا) ، والذي تم تضمينه في كتاب غينيس للأرقام القياسية في 23 أبريل 2016
حمض النووي الريبي منقوص الأكسجين. معلومات عامة
الحمض النووي (الحمض النووي الريبي منقوص الأكسجين) هو نوع من مخطط الحياة ، وهو رمز معقد يحتوي على بيانات حول المعلومات الوراثية. هذا الجزيء المعقد قادر على تخزين ونقل المعلومات الجينية الوراثية من جيل إلى جيل. يحدد الحمض النووي خصائص أي كائن حي مثل الوراثة والتنوع. تحدد المعلومات المشفرة فيه برنامج التطوير الكامل لأي كائن حي. العوامل المضمنة وراثيًا تحدد مسبقًا مجرى حياة كل من الشخص وأي كائن حي آخر. يمكن أن يؤثر التأثير الاصطناعي أو الطبيعي للبيئة الخارجية بشكل طفيف فقط على الشدة الكلية للصفات الجينية الفردية أو يؤثر على تطوير العمليات المبرمجة.
حمض النووي الريبي منقوص الأكسجين(DNA) هو جزيء ضخم (أحد الجزيئات الرئيسية الثلاثة ، والاثنان الآخران هما RNA والبروتينات) ، والذي يوفر التخزين والانتقال من جيل إلى جيل وتنفيذ البرنامج الجيني لتطوير وتشغيل الكائنات الحية. يحتوي الحمض النووي على معلومات حول بنية أنواع مختلفة من الحمض النووي الريبي والبروتينات.
في الخلايا حقيقية النواة (الحيوانات والنباتات والفطريات) ، يوجد الحمض النووي في نواة الخلية كجزء من الكروموسومات ، وكذلك في بعض عضيات الخلية (الميتوكوندريا والبلاستيدات). في خلايا الكائنات بدائية النواة (البكتيريا والعتائق) ، يتم توصيل جزيء DNA دائري أو خطي ، يسمى نوكليويد ، من الداخل بغشاء الخلية. لديهم وكذلك حقيقيات النوى السفلية (على سبيل المثال ، الخميرة) أيضًا جزيئات DNA صغيرة مستقلة ، معظمها دائرية تسمى البلازميدات.
من وجهة نظر كيميائية ، الحمض النووي عبارة عن جزيء بوليمري طويل يتكون من كتل متكررة - نيوكليوتيدات. يتكون كل نوكليوتيد من قاعدة نيتروجينية وسكر (ديوكسيريبوز) ومجموعة فوسفات. تتشكل الروابط بين النيوكليوتيدات في سلسلة بواسطة deoxyribose ( مع) والفوسفات ( F) المجموعات (روابط الفوسفوديستر).

أرز. 2. يتكون نوكليرتيد من قاعدة نيتروجينية وسكر (ديوكسيريبوز) ومجموعة فوسفات
في الغالبية العظمى من الحالات (باستثناء بعض الفيروسات التي تحتوي على DNA أحادي الجديلة) ، يتكون جزيء الحمض النووي من سلسلتين موجهتين بقواعد نيتروجينية لبعضهما البعض. هذا الجزيء مزدوج الشريطة ملتوي في حلزون.
هناك أربعة أنواع من القواعد النيتروجينية الموجودة في الحمض النووي (الأدينين ، والجوانين ، والثيمين ، والسيتوزين). ترتبط القواعد النيتروجينية لإحدى السلاسل بالقواعد النيتروجينية للسلسلة الأخرى بواسطة روابط هيدروجينية وفقًا لمبدأ التكامل: يتحد الأدينين مع الثايمين فقط ( في) ، الجوانين - فقط مع السيتوزين ( جي سي). هذه الأزواج هي التي تشكل "درجات" "السلم" الحلزوني للحمض النووي (انظر: الشكل 2 و 3 و 4).

أرز. 2. القواعد النيتروجينية
يسمح لك تسلسل النيوكليوتيدات "بتشفير" المعلومات حول أنواع مختلفة من الحمض النووي الريبي ، وأهمها المعلومات أو القوالب (mRNA) والريبوسوم (الرنا الريباسي) والنقل (الحمض الريبي النووي النقال). يتم تصنيع كل هذه الأنواع من الحمض النووي الريبي في قالب الحمض النووي عن طريق نسخ تسلسل الحمض النووي في تسلسل الحمض النووي الريبي المركب أثناء النسخ والمشاركة في التخليق الحيوي للبروتين (عملية الترجمة). بالإضافة إلى تسلسلات الترميز ، يحتوي الحمض النووي للخلية على متواليات تؤدي وظائف تنظيمية وهيكلية.

أرز. 3. تكرار الحمض النووي
يوفر موقع التركيبات الأساسية لمركبات الحمض النووي الكيميائية والنسب الكمية بين هذه المجموعات ترميزًا للمعلومات الوراثية.
تعليم DNA جديد (تكرار)
- عملية التكاثر: فك الحلزون المزدوج للحمض النووي - تخليق الخيوط التكميلية بواسطة بوليميراز الدنا - تكوين جزيئين DNA من واحد.
- ينفصل اللولب المزدوج عن فرعين عندما تكسر الإنزيمات الرابطة بين أزواج القواعد من المركبات الكيميائية.
- كل فرع هو عنصر DNA جديد. ترتبط الأزواج الأساسية الجديدة بنفس التسلسل كما في الفرع الأصلي.
عند الانتهاء من الازدواجية ، يتم تكوين حلقتين مستقلتين ، يتم إنشاؤهما من المركبات الكيميائية للحمض النووي الأصل ولها نفس الشفرة الجينية معها. بهذه الطريقة ، يمكن للحمض النووي أن يمزق المعلومات من خلية إلى أخرى.
معلومات أكثر تفصيلا:
هيكل الأحماض النووية

أرز. 4. القواعد النيتروجينية: الأدينين ، الجوانين ، السيتوزين ، الثايمين
حمض النووي الريبي منقوص الأكسجينيشير (DNA) إلى الأحماض النووية. احماض نوويةهي فئة من البوليمرات الحيوية غير المنتظمة التي تكون مونومراتها نيوكليوتيدات.
نيوكليوتيداتيتألف من قاعدة نيتروجينية، متصلة بخمسة كربون كربوهيدرات (بنتوز) - ديوكسيريبوز(في حالة DNA) أو ريبوز(في حالة الحمض النووي الريبي) ، الذي يتحد مع بقايا حمض الفوسفوريك (H 2 PO 3 -).
القواعد النيتروجينيةهناك نوعان: قواعد بيريميدين - اليوراسيل (فقط في الحمض النووي الريبي) ، والسيتوزين والثايمين ، وقواعد البيورين - الأدينين والجوانين.

أرز. الشكل 5. بنية النيوكليوتيدات (يسار) ، موقع النيوكليوتيدات في الحمض النووي (أسفل) وأنواع القواعد النيتروجينية (على اليمين): بيريميدين وبيورين

يتم ترقيم ذرات الكربون في جزيء البنتوز من 1 إلى 5. يتحد الفوسفات مع ذرات الكربون الثالثة والخامسة. هذه هي الطريقة التي ترتبط بها الأحماض النووية معًا لتشكيل سلسلة من الأحماض النووية. وبالتالي ، يمكننا عزل الأطراف 3 'و 5' من حبلا DNA:

أرز. 6. عزل طرفي 3 و 5 من خيط DNA
شريطين من شكل DNA الحلزون المزدوج. هذه السلاسل في دوامة موجهة في اتجاهين متعاكسين. في خيوط مختلفة من الحمض النووي ، ترتبط القواعد النيتروجينية ببعضها البعض عن طريق روابط هيدروجينية. يتحد الأدينين دائمًا مع الثايمين ، ويجمع السيتوزين دائمًا مع الجوانين. يدعي حكم التكامل.
قاعدة التكامل:
| أيه تي جي سي |
على سبيل المثال ، إذا تم إعطاؤنا خيط DNA يحتوي على التسلسل
3'-ATGTCCTAGCTGCTCG - 5 '،
ثم ستكون السلسلة الثانية مكملة لها وموجهة في الاتجاه المعاكس - من الطرف 5 إلى النهاية 3:
5'- TACAGGATCGACGAGC- 3 '.

أرز. 7. اتجاه سلاسل جزيء DNA وربط القواعد النيتروجينية باستخدام روابط الهيدروجين
تكرار الحمض النووي
تكرار الحمض النوويهي عملية مضاعفة جزيء الحمض النووي عن طريق تخليق القالب. في معظم حالات تكاثر الحمض النووي الطبيعيالتمهيديلتخليق الحمض النووي مقتطف قصير (تم إنشاؤه مرة أخرى). يتم إنشاء مثل هذا التمهيدي الريبونوكليوتيد بواسطة إنزيم بريماز (إنزيم بريميز في بدائيات النوى ، بوليميريز الحمض النووي في حقيقيات النوى) ، ويتم استبداله لاحقًا ببوليميراز ديوكسي ريبونوكليوتيد ، والذي يؤدي عادةً وظائف الإصلاح (تصحيح الضرر الكيميائي والكسر في جزيء الحمض النووي).
يحدث النسخ المتماثل بطريقة شبه محافظة. هذا يعني أن اللولب المزدوج للحمض النووي ينفصل ويتم إكمال سلسلة جديدة على كل من سلاسله وفقًا لمبدأ التكامل. وهكذا يحتوي جزيء الدنا الوليدي على خيط واحد من الجزيء الأصلي وآخر مُصنَّع حديثًا. يحدث النسخ المتماثل في الاتجاه من 3 إلى 5 من الخيط الأصلي.

أرز. 8. تكرار (مضاعفة) جزيء DNA
تخليق الحمض النووي- هذه ليست عملية معقدة كما قد تبدو للوهلة الأولى. إذا فكرت في الأمر ، فأنت بحاجة أولاً إلى معرفة ما هو التوليف. إنها عملية الجمع بين شيء ما. يتم تكوين جزيء DNA الجديد على عدة مراحل:
1) يقطع DNA topoisomerase ، الموجود أمام شوكة النسخ ، الحمض النووي لتسهيل فكه وفكه.
2) إن هيليكاز DNA ، التي تتبع توبويزوميراز ، تؤثر على عملية "فك" حلزون الحمض النووي.
3) تقوم البروتينات المرتبطة بالحمض النووي بربط خيوط الدنا ، وكذلك تقوم بتثبيتها ، مما يمنعها من الالتصاق ببعضها البعض.
4) بوليميريز الحمض النووي δ(دلتا) ، بالتنسيق مع سرعة حركة شوكة النسخ المتماثل ، يؤدي التوليفقيادةالسلاسلشركة فرعية الحمض النووي في الاتجاه 5 "→ 3" على المصفوفةالأم خيوط من الحمض النووي في الاتجاه من نهايته 3 "إلى 5" (سرعة تصل إلى 100 زوج قاعدي في الثانية). هذه الأحداث على هذا الأمخيوط الحمض النووي محدودة.

أرز. 9. تمثيل تخطيطي لعملية تكرار الحمض النووي: (1) الخيط المتأخر (الخيط المتأخر) ، (2) الخيط الرئيسي (الخيط الرئيسي) ، (3) بوليميراز الدنا α (Polα) ، (4) DNA ligase ، (5) RNA -برويمر ، (6) بريماز ، (7) جزء أوكازاكي ، (8) بوليميريز DNA δ (Pol) ، (9) هيليكاز ، (10) بروتينات ربط الحمض النووي أحادية السلسلة ، (11) توبويزوميراز.
يتم وصف تركيب خيط DNA الابنة المتأخر أدناه (انظر أدناه). مخططشوكة النسخ المتماثل ووظيفة إنزيمات النسخ)
لمزيد من المعلومات حول تكرار الحمض النووي ، انظر
5) مباشرة بعد فك وتثبيت حبلا آخر من الجزيء الأصل ، ينضمبوليميريز DNA α(ألفا)وفي الاتجاه 5 "→ 3" يصنع التمهيدي (التمهيدي RNA) - تسلسل RNA على قالب DNA بطول يتراوح من 10 إلى 200 نيوكليوتيد. بعد ذلك الانزيمإزالتها من حبلا الحمض النووي.
بدلا من بوليميريز الحمض النوويα
تعلق على 3 "نهاية التمهيديبوليميريز الحمض النوويε
.
6)
بوليميريز الحمض النوويε
(إبسيلون) كما لو استمر في إطالة التمهيدي ، ولكن كركيزة مضمنةديوكسي ريبونوكليوتيدات(بكمية 150-200 نيوكليوتيدات). نتيجة لذلك ، يتكون خيط صلب من جزأين -RNA(أي التمهيدي) و الحمض النووي.
بوليميريز الحمض النووي εيعمل حتى يصادف التمهيدي السابقجزء اوكازاكي(تم تصنيعه قبل ذلك بقليل). ثم يتم إزالة هذا الإنزيم من السلسلة.
7) بوليميريز الحمض النووي β(بيتا) يقف في مكانبوليميرات الحمض النووي ε ،يتحرك في نفس الاتجاه (5 "→ 3") ويزيل الريبونوكليوتيدات التمهيدي أثناء إدخال ديوكسي ريبونوكليوتيدات في مكانها. يعمل الإنزيم حتى الإزالة الكاملة للبرايمر ، أي حتى ديوكسي ريبونوكليوتيد (تم تصنيعه أكثر من قبلبوليميريز الحمض النووي ε). الإنزيم غير قادر على ربط نتيجة عمله بالحمض النووي الموجود في المقدمة ، فيخرج من السلسلة.
نتيجة لذلك ، "يقع" جزء من DNA الابنة على مصفوفة الخيط الأم. يدعيجزء من أوكازاكي.
8) ligase DNA ligates اثنان متجاوران شظايا أوكازاكي ، بمعنى آخر. 5 "- نهاية المقطع ، توليفهابوليميريز الحمض النووي ε ،و 3 "نهاية سلسلة مدمجةبوليميريز الحمض النوويβ .
هيكل الحمض النووي الريبي
حمض النووي الريبي(RNA) هو واحد من ثلاثة جزيئات رئيسية (الاثنان الآخران هما DNA والبروتينات) الموجودة في خلايا جميع الكائنات الحية.
تمامًا مثل الحمض النووي ، يتكون الحمض النووي الريبي من سلسلة طويلة يُسمى فيها كل رابط النوكليوتيدات. يتكون كل نوكليوتيد من قاعدة نيتروجينية وسكر ريبوز ومجموعة فوسفات. ومع ذلك ، على عكس الحمض النووي ، فإن الحمض النووي الريبي عادة ما يحتوي على واحد بدلاً من خيطين. يتم تمثيل Pentose في RNA بواسطة الريبوز ، وليس deoxyribose (يحتوي الريبوز على مجموعة هيدروكسيل إضافية على ذرة الكربوهيدرات الثانية). أخيرًا ، يختلف الحمض النووي عن الحمض النووي الريبي في تكوين القواعد النيتروجينية: بدلا من الثايمين ( تي) اليوراسيل موجود في الحمض النووي الريبي ( يو) ، وهو أيضًا مكمل للأدينين.
يسمح تسلسل النيوكليوتيدات لـ RNA بتشفير المعلومات الجينية. تستخدم جميع الكائنات الخلوية الحمض النووي الريبي (مرنا) لبرمجة تخليق البروتين.
يتم تشكيل الحمض النووي الريبي الخلوي في عملية تسمى النسخ ، أي تخليق الحمض النووي الريبي (RNA) على قالب DNA ، بواسطة إنزيمات خاصة - بوليميرات الحمض النووي الريبي.
ثم تشارك Messenger RNAs (mRNAs) في عملية تسمى إذاعة، أولئك. تخليق البروتين على قالب الرنا المرسال بمشاركة الريبوسومات. تخضع الرناوات الأخرى لتعديلات كيميائية بعد النسخ ، وبعد تكوين الهياكل الثانوية والثالثية ، فإنها تؤدي وظائف تعتمد على نوع الحمض النووي الريبي.

أرز. 10. الفرق بين DNA و RNA من حيث القاعدة النيتروجينية: بدلاً من الثايمين (T) ، يحتوي RNA على uracil (U) ، وهو أيضًا مكمل للأدينين.
الكتابة
هذه هي عملية تخليق الحمض النووي الريبي على قالب الحمض النووي. يسترخى الحمض النووي في أحد المواقع. تحتوي إحدى السلاسل على معلومات يجب نسخها على جزيء الحمض النووي الريبي - وتسمى هذه السلسلة بالترميز. يُطلق على الخيط الثاني من الحمض النووي ، وهو مكمل لخيط التشفير ، خيط القالب. في عملية النسخ على سلسلة القالب في اتجاه 3'-5 '(على طول سلسلة DNA) ، يتم تصنيع سلسلة RNA مكملة لها. وبالتالي ، يتم إنشاء نسخة RNA من حبلا التشفير.

أرز. 11. تمثيل تخطيطي للنسخ
على سبيل المثال ، إذا تم إعطاؤنا تسلسل حبلا الترميز
3'-ATGTCCTAGCTGCTCG - 5 '،
ثم ، وفقًا لقاعدة التكامل ، ستحمل سلسلة المصفوفة التسلسل
5'- TACAGGATCGACGAGC- 3 '،
و RNA المركب منه هو التسلسل
إذاعة
ضع في اعتبارك الآلية تخليق البروتينعلى مصفوفة الحمض النووي الريبي ، وكذلك الكود الجيني وخصائصه. للتوضيح أيضًا ، على الرابط أدناه ، نوصي بمشاهدة مقطع فيديو قصير حول عمليات النسخ والترجمة التي تحدث في خلية حية:

أرز. 12. عملية تخليق البروتين: أكواد DNA لـ RNA ، رموز RNA للبروتين
الكود الجيني
الكود الجيني- طريقة ترميز تسلسل الأحماض الأمينية للبروتينات باستخدام سلسلة من النيوكليوتيدات. يتم ترميز كل حمض أميني بواسطة سلسلة من ثلاثة نيوكليوتيدات - كودون أو ثلاثي.
الكود الجيني شائع لمعظم الكائنات الأولية وحقيقيات النوى. يسرد الجدول جميع الكودونات الـ 64 ويسرد الأحماض الأمينية المقابلة. الترتيب الأساسي من 5 "إلى 3" نهاية mRNA.
الجدول 1. الكود الجيني القياسي
|
الأول نيي |
القاعدة الثانية |
الثالث نيي |
|||||||
|
يو |
ج |
أ |
جي |
||||||
|
يو |
يو يو يو |
(Phe / F) |
يو سي يو |
(Ser / S) |
يو ايه يو |
(صور / ص) |
يو جي يو |
(Cys / C) |
يو |
|
يو يو سي |
يو سي سي |
يو أ ج |
يو جي سي |
ج |
|||||
|
يو يو أ |
(ليو / لتر) |
ش كاليفورنيا |
يو أ أ |
وقف كودون ** |
يو جي أ |
وقف كودون ** |
أ |
||
|
يو يو جي |
يو سي جي |
يو ايه جي |
وقف كودون ** |
يو جي جي |
(Trp / W) |
جي |
|||
|
ج |
سي يو يو |
سي سي يو |
(دعم) |
سي أ يو |
(صاحب / ح) |
سي جي يو |
(أرج / ص) |
يو |
|
|
سي يو سي |
ج ج ج |
ج أ ج |
ج ج ج |
ج |
|||||
|
سي يو أ |
ج ج أ |
ج أ أ |
(Gln / Q) |
CGA |
أ |
||||
|
سي يو جي |
سي سي جي |
سي أ ز |
سي جي جي |
جي |
|||||
|
أ |
يو يو |
(إيل / أنا) |
أ سي يو |
(Thr / T) |
أ أ يو |
(أسن / ن) |
أ جي يو |
(Ser / S) |
يو |
|
أ يو سي |
أ ج ج |
أ أ ج |
أ ج ج |
ج |
|||||
|
أ يو أ |
أ ج أ |
أ أ أ |
(ليس / ك) |
أ ز أ |
أ |
||||
|
أ يو جي |
(ميت / م) |
أ سي جي |
أ أ ج |
ايه جي جي |
جي |
||||
|
جي |
جي يو يو |
(فال / V) |
جي سي يو |
(علاء) |
G A U |
(جنوب / د) |
جي جي يو |
(Gly / G) |
يو |
|
جي يو سي |
مجلس التعاون الخليجي |
ز أ ج |
جي جي سي |
ج |
|||||
|
جي يو أ |
جي سي أ |
جي أ أ |
(صمغ) |
جي جي أ |
أ |
||||
|
G U G |
جي سي جي |
جي ايه جي |
جي جي جي |
جي |
|||||
من بين الثلاثة توائم ، هناك 4 متواليات خاصة تعمل كـ "علامات ترقيم":
- * ثلاثي أغسطس، ويسمى أيضا ترميز الميثيونين ابدأ الكودون. يبدأ هذا الكودون في تخليق جزيء البروتين. وهكذا ، أثناء تخليق البروتين ، سيكون أول حمض أميني في التسلسل هو المثيونين دائمًا.
- **ثلاثة توائم UAA, UAGو UGAاتصل وقف الكودوناتولا ترميز لأي أحماض أمينية. في هذه التسلسلات ، يتوقف تخليق البروتين.
خصائص الكود الجيني
1. الثلاثية. يتم ترميز كل حمض أميني بواسطة سلسلة من ثلاثة نيوكليوتيدات - ثلاثي أو كودون.
2. الاستمرارية. لا توجد نيوكليوتيدات إضافية بين التوائم الثلاثة ، المعلومات تُقرأ باستمرار.
3. عدم التداخل. لا يمكن أن يكون نوكليوتيد واحد جزءًا من اثنين من ثلاثة توائم في نفس الوقت.
4. التفرد. يمكن أن يرمز كودون واحد لحمض أميني واحد فقط.

5. الانحطاط. يمكن ترميز أحد الأحماض الأمينية بعدة أكواد مختلفة.

6. براعة. الشفرة الجينية هي نفسها لجميع الكائنات الحية.
مثال. حصلنا على تسلسل حبلا الترميز:
3’- CCGATTGCACGTCGATCGTATA- 5’.
سلسلة المصفوفة سيكون لها التسلسل:
5’- جكتاكجتجكاجكتاجكات- 3’.
الآن نقوم "بتوليف" المعلوماتية RNA من هذه السلسلة:
3’- CCGAUGCACGUCGAUCGUAUA- 5’.
يذهب تخليق البروتين في الاتجاه 5 '→ 3' ، لذلك ، نحتاج إلى قلب التسلسل من أجل "قراءة" الشفرة الجينية:
5’- آوغكواغكوجكاكجواغكك- 3’.
الآن ابحث عن كود البدء AUG:
5’- AU أوغ كواجكوجكاكجواغكك- 3’.
قسّم التسلسل إلى ثلاثة توائم:
يبدو كالتالي: يتم نقل المعلومات من الحمض النووي إلى RNA (النسخ) ، من RNA إلى البروتين (الترجمة). يمكن أيضًا تكرار الحمض النووي عن طريق النسخ المتماثل ، كما أن عملية النسخ العكسي ممكنة أيضًا ، عندما يتم تصنيع الحمض النووي من قالب RNA ، ولكن هذه العملية تتميز بشكل أساسي بالفيروسات.

أرز. 13. العقيدة المركزية للبيولوجيا الجزيئية
الجينوم: الجينات والكروموسومات
(المفاهيم العامة)
الجينوم - مجموع كل جينات الكائن الحي ؛ مجموعة الكروموسوم الكاملة.
تم اقتراح مصطلح "الجينوم" من قبل G. أشار المعنى الأصلي لهذا المصطلح إلى أن مفهوم الجينوم ، على عكس النمط الجيني ، هو خاصية وراثية للأنواع ككل ، وليس للفرد. مع تطور علم الوراثة الجزيئي ، تغير معنى هذا المصطلح. من المعروف أن الحمض النووي ، الذي يحمل المعلومات الجينية في معظم الكائنات الحية ، وبالتالي يشكل أساس الجينوم ، لا يشمل فقط الجينات بالمعنى الحديث للكلمة. يتم تمثيل معظم الحمض النووي للخلايا حقيقية النواة من خلال متواليات نوكليوتيد غير مشفرة ("زائدة عن الحاجة") لا تحتوي على معلومات حول البروتينات والأحماض النووية. وبالتالي ، فإن الجزء الرئيسي من جينوم أي كائن حي هو الحمض النووي الكامل لمجموعته الفردية من الكروموسومات.
الجينات هي أجزاء من جزيئات الحمض النووي التي ترمز إلى عديد الببتيدات وجزيئات الحمض النووي الريبي.
على مدى القرن الماضي ، تغير فهمنا للجينات بشكل كبير. في السابق ، كان الجينوم عبارة عن منطقة من الكروموسوم تقوم بترميز أو تحديد سمة واحدة أو النمط الظاهري(مرئية) ، مثل لون العين.
في عام 1940 ، اقترح جورج بيدل وإدوارد تاثام تعريفًا جزيئيًا للجين. عالج العلماء جراثيم الفطريات نيوروسبورا كراساالأشعة السينية والعوامل الأخرى التي تسبب تغيرات في تسلسل الحمض النووي ( الطفرات) ، ووجدت سلالات متحولة من الفطريات فقدت بعض الإنزيمات المحددة ، والتي أدت في بعض الحالات إلى تعطيل المسار الأيضي بأكمله. توصل Beadle و Tatham إلى استنتاج مفاده أن الجين هو جزء من المادة الجينية التي تحدد أو ترمز لإنزيم واحد. هذه هي طريقة الفرضية "جين واحد ، إنزيم واحد". تم تمديد هذا المفهوم لاحقًا ليشمل التعريف "جين واحد - عديد ببتيد واحد"، نظرًا لأن العديد من الجينات تشفر بروتينات ليست إنزيمات ، ويمكن أن يكون عديد الببتيد وحدة فرعية لمركب بروتيني معقد.
على التين. يوضح الشكل 14 مخططًا لكيفية تحديد ثلاثة توائم من الحمض النووي متعدد الببتيد ، وهو تسلسل الأحماض الأمينية للبروتين ، بوساطة mRNA. يلعب أحد خيوط الحمض النووي دور قالب لتخليق الرنا المرسال ، وثلاثيات النوكليوتيدات (الكودونات) مكملة لثلاثة توائم من الحمض النووي. في بعض البكتيريا والعديد من حقيقيات النوى ، يتم مقاطعة تسلسلات الترميز بواسطة مناطق غير مشفرة (تسمى الإنترونات).
التعريف الكيميائي الحيوي الحديث للجين بشكل أكثر تحديدًا. الجينات هي جميع أقسام الحمض النووي التي تشفر التسلسل الأولي للمنتجات النهائية ، والتي تشمل عديد الببتيدات أو الحمض النووي الريبي التي لها وظيفة هيكلية أو تحفيزية.
إلى جانب الجينات ، يحتوي الحمض النووي أيضًا على متواليات أخرى تؤدي وظيفة تنظيمية حصرية. التسلسلات التنظيميةقد يشير إلى بداية الجينات أو نهايتها ، أو يؤثر على النسخ ، أو يشير إلى موقع بدء النسخ المتماثل أو إعادة التركيب. يمكن التعبير عن بعض الجينات بطرق مختلفة ، حيث تعمل نفس القطعة من الحمض النووي كقالب لتشكيل منتجات مختلفة.
يمكننا الحساب تقريبًا الحد الأدنى لحجم الجينالترميز للبروتين الوسيط. يتم ترميز كل حمض أميني في سلسلة بولي ببتيد بواسطة سلسلة من ثلاثة نيوكليوتيدات ؛ تتوافق تسلسلات هذه الثلاثيات (الكودونات) مع سلسلة الأحماض الأمينية في عديد الببتيد المشفر بواسطة الجين المحدد. تتوافق سلسلة البولي ببتيد المكونة من 350 من مخلفات الأحماض الأمينية (سلسلة متوسطة الطول) مع تسلسل 1050 زوج قاعدي. ( بي بي). ومع ذلك ، فإن العديد من الجينات حقيقية النواة وبعض الجينات بدائية النواة تنقطع عن طريق شرائح الحمض النووي التي لا تحمل معلومات عن البروتين ، وبالتالي يتبين أنها أطول بكثير مما تظهره عملية حسابية بسيطة.
كم عدد الجينات الموجودة على كروموسوم واحد؟
 أرز. 15. منظر للكروموسومات في الخلايا بدائية النواة (يسار) وحقيقية النواة. الهستونات هي فئة واسعة من البروتينات النووية التي تؤدي وظيفتين رئيسيتين: تشارك في تغليف خيوط الحمض النووي في النواة وفي التنظيم اللاجيني للعمليات النووية مثل النسخ والتكرار والإصلاح.
أرز. 15. منظر للكروموسومات في الخلايا بدائية النواة (يسار) وحقيقية النواة. الهستونات هي فئة واسعة من البروتينات النووية التي تؤدي وظيفتين رئيسيتين: تشارك في تغليف خيوط الحمض النووي في النواة وفي التنظيم اللاجيني للعمليات النووية مثل النسخ والتكرار والإصلاح.
كما تعلم ، تحتوي الخلايا البكتيرية على كروموسوم على شكل خيط DNA ، معبأ في بنية مدمجة - نواة. كروموسوم بدائية النواة الإشريكية القولونية، الجينوم الذي تم فك تشفيره بالكامل ، هو جزيء دائري من الحمض النووي (في الواقع ، هذه ليست دائرة منتظمة ، بل هي حلقة بدون بداية ونهاية) ، وتتألف من 4639675 نقطة أساس. يحتوي هذا التسلسل على ما يقرب من 4300 جين بروتين و 157 جينًا آخر لجزيئات الحمض النووي الريبي المستقرة. الخامس الجينات البشريةما يقرب من 3.1 مليار زوج أساسي يقابل ما يقرب من 29000 جين موجود في 24 كروموسومًا مختلفًا.
بدائيات النوى (البكتيريا).
 البكتيريا بكتريا قولونيةيحتوي على جزيء DNA دائري مزدوج السلسلة. يتكون من 4،639،675 برميل. ويصل طولها إلى 1.7 مم تقريبًا ، وهو ما يتجاوز طول الخلية نفسها بكتريا قولونيةحوالي 850 مرة. بالإضافة إلى الكروموسوم الدائري الكبير كجزء من النواة ، تحتوي العديد من البكتيريا على واحد أو أكثر من جزيئات DNA الدائرية الصغيرة الموجودة بحرية في العصارة الخلوية. تسمى هذه العناصر خارج الصبغية البلازميدات(الشكل 16).
البكتيريا بكتريا قولونيةيحتوي على جزيء DNA دائري مزدوج السلسلة. يتكون من 4،639،675 برميل. ويصل طولها إلى 1.7 مم تقريبًا ، وهو ما يتجاوز طول الخلية نفسها بكتريا قولونيةحوالي 850 مرة. بالإضافة إلى الكروموسوم الدائري الكبير كجزء من النواة ، تحتوي العديد من البكتيريا على واحد أو أكثر من جزيئات DNA الدائرية الصغيرة الموجودة بحرية في العصارة الخلوية. تسمى هذه العناصر خارج الصبغية البلازميدات(الشكل 16).
تتكون معظم البلازميدات فقط من بضعة آلاف من أزواج القواعد ، وبعضها يحتوي على أكثر من 10000 زوج قاعدي. تحمل المعلومات الجينية وتتضاعف لتكوين اللازميدات الوليدة ، التي تدخل الخلايا الوليدة أثناء انقسام الخلية الأم. توجد البلازميدات ليس فقط في البكتيريا ، ولكن أيضًا في الخميرة والفطريات الأخرى. في كثير من الحالات ، لا تقدم البلازميدات أي ميزة للخلايا المضيفة ووظيفتها الوحيدة هي التكاثر بشكل مستقل. ومع ذلك ، تحمل بعض البلازميدات جينات مفيدة للمضيف. على سبيل المثال ، يمكن للجينات الموجودة في البلازميدات أن تمنح مقاومة للعوامل المضادة للبكتيريا في الخلايا البكتيرية. تمنح البلازميدات التي تحمل جين بيتا لاكتاماز مقاومة للمضادات الحيوية بيتا لاكتام مثل البنسلين والأموكسيسيلين. يمكن أن تنتقل البلازميدات من الخلايا المقاومة للمضادات الحيوية إلى خلايا أخرى من نفس النوع أو أنواع بكتيرية مختلفة ، مما يتسبب في أن تصبح هذه الخلايا مقاومة أيضًا. الاستخدام المكثف للمضادات الحيوية هو عامل انتقائي قوي يعزز انتشار البلازميدات التي تشفر مقاومة المضادات الحيوية (وكذلك الينقولات التي تشفر الجينات المماثلة) بين البكتيريا المسببة للأمراض ، ويؤدي إلى ظهور سلالات بكتيرية ذات مقاومة للعديد من المضادات الحيوية. بدأ الأطباء في فهم مخاطر استخدام المضادات الحيوية على نطاق واسع ووصفهم فقط عند الضرورة القصوى. لأسباب مماثلة ، فإن الاستخدام الواسع للمضادات الحيوية لعلاج حيوانات المزرعة محدود.
أنظر أيضا: Ravin N.V. ، شيستاكوف S.V. جينوم بدائيات النوى // مجلة فافيلوف للوراثة والتربية ، 2013. V. 17. No. 4/2. ص 972-984.
حقيقيات النواة.
الجدول 2. الحمض النووي والجينات والكروموسومات لبعض الكائنات الحية
|
الحمض النووي المشترك ، ب. |
عدد الكروموسومات * |
العدد التقريبي للجينات |
|
|
الإشريكية القولونية(بكتيريا) |
4 639 675 |
4 435 |
|
|
خميرة الخميرة(خميرة) |
12 080 000 |
16** |
5 860 |
|
أنواع معينة انيقة(دودة خيطية) |
90 269 800 |
12*** |
23 000 |
|
نبات الأرابيدوبسيس thaliana(مصنع) |
119 186 200 |
33 000 |
|
|
ذبابة الفاكهة سوداء البطن(ذبابة الفاكهة) |
120 367 260 |
20 000 |
|
|
أرز أسيوي(أرز) |
480 000 000 |
57 000 |
|
|
عضلة المصحف(الفأر) |
2 634 266 500 |
27 000 |
|
|
الانسان العاقل(بشر) |
3 070 128 600 |
29 000 |
ملحوظة.يتم تحديث المعلومات باستمرار ؛ لمزيد من المعلومات المحدثة ، راجع مواقع الويب الخاصة بالمشروع الجينومي الفردي.
* بالنسبة لجميع حقيقيات النوى ، باستثناء الخميرة ، يتم إعطاء المجموعة ثنائية الصبغيات من الكروموسومات. ثنائي الصيغة الصبغيةعدة الكروموسومات (من دبلومات يونانية - مزدوج و eidos - عرض) - مجموعة مزدوجة من الكروموسومات (2n) ، كل منها له مجموعة متجانسة.
** مجموعة هابلويد. تحتوي سلالات الخميرة البرية عادةً على ثماني مجموعات (ثماني الصبغيات) أو أكثر من هذه الكروموسومات.
*** للإناث مع اثنين من الكروموسومات X. الذكور لديهم كروموسوم X ، ولكن ليس لديهم كروموسوم Y ، أي 11 كروموسوم فقط.
تحتوي خلية الخميرة ، وهي واحدة من أصغر حقيقيات النوى ، على حمض نووي 2.6 مرة أكثر من الخلية بكتريا قولونية(الجدول 2). خلايا ذبابة الفاكهة ذبابة الفاكهةوهو كائن تقليدي من الأبحاث الجينية ، ويحتوي على 35 مرة من الحمض النووي ، وتحتوي الخلايا البشرية على حوالي 700 مرة من الحمض النووي أكثر من الخلايا بكتريا قولونية.تحتوي العديد من النباتات والبرمائيات على المزيد من الحمض النووي. يتم تنظيم المادة الوراثية للخلايا حقيقية النواة في شكل كروموسومات. مجموعة ثنائية الصبغيات من الكروموسومات (2 ن) يعتمد على نوع الكائن الحي (الجدول 2).
على سبيل المثال ، يوجد في الخلية الجسدية البشرية 46 كروموسومًا ( أرز. 17). كل كروموسوم في خلية حقيقية النواة ، كما هو موضح في الشكل. 17 ، أ، يحتوي على جزيء DNA مزدوج الشريطة كبير جدًا. أربعة وعشرون كروموسومًا بشريًا (22 كروموسومًا مزدوجًا واثنان من الكروموسومات الجنسية X و Y) تختلف في الطول بأكثر من 25 مرة. يحتوي كل كروموسوم حقيقي النواة على مجموعة محددة من الجينات.

أرز. 17. الكروموسومات حقيقية النواة.أ- زوج من الكروماتيدات الشقيقة المتصلة والمكثفة من الكروموسوم البشري. في هذا الشكل ، تبقى الكروموسومات حقيقية النواة بعد التكرار وفي الطور الطوري أثناء الانقسام. ب- مجموعة كاملة من الكروموسومات من الكريات البيض لأحد مؤلفي الكتاب. تحتوي كل خلية جسدية بشرية طبيعية على 46 كروموسومًا.
إذا قمت بتوصيل جزيئات الحمض النووي للجينوم البشري (22 كروموسوم وكروموسومات X و Y أو X و X) ، تحصل على تسلسل يبلغ طوله حوالي متر واحد. ملاحظة: في جميع الثدييات والكائنات الذكورية غير المتجانسة الأخرى ، تمتلك الإناث صبغيين X (XX) وللذكور كروموسوم X واحد وكروموسوم Y واحد (XY).
معظم الخلايا البشرية ، لذلك يبلغ الطول الإجمالي للحمض النووي لهذه الخلايا حوالي 2 متر. يمتلك الإنسان البالغ حوالي 10 14 خلية ، وبالتالي فإن الطول الإجمالي لجميع جزيئات الحمض النووي هو 2 × 10 11 كم. للمقارنة ، يبلغ محيط الأرض 4 × 10 4 كم ، والمسافة من الأرض إلى الشمس 1.5 × 10 8 كم. هذا هو مدى وجود الحمض النووي المضغوط بشكل مدهش في خلايانا!
في الخلايا حقيقية النواة ، توجد عضيات أخرى تحتوي على الحمض النووي - وهي الميتوكوندريا والبلاستيدات الخضراء. تم طرح العديد من الفرضيات فيما يتعلق بأصل الحمض النووي للميتوكوندريا والبلاستيدات الخضراء. وجهة النظر المقبولة عمومًا اليوم هي أنها بدائل كروموسومات البكتيريا القديمة التي اخترقت سيتوبلازم الخلايا المضيفة وأصبحت سلائف هذه العضيات. أكواد الحمض النووي للميتوكوندريا لـ tRNA و rRNA للميتوكوندريا ، بالإضافة إلى العديد من بروتينات الميتوكوندريا. يتم ترميز أكثر من 95٪ من بروتينات الميتوكوندريا بواسطة DNA النووي.
هيكل الجينات
ضع في اعتبارك بنية الجين في بدائيات النوى وحقيقيات النوى ، وأوجه التشابه والاختلاف بينهما. على الرغم من حقيقة أن الجين هو جزء من DNA يشفر بروتينًا واحدًا فقط أو RNA ، بالإضافة إلى جزء الترميز المباشر ، فإنه يتضمن أيضًا عناصر تنظيمية وعناصر هيكلية أخرى لها بنية مختلفة في بدائيات النوى وحقيقيات النوى.
تسلسل الترميز- الوحدة الهيكلية والوظيفية الرئيسية للجين ، حيث يتم ترميز ثلاثة توائم من النيوكليوتيداتتسلسل الأحماض الأمينية. يبدأ برمز البداية وينتهي برمز التوقف.
قبل وبعد تسلسل الترميز متواليات 5 'و 3' غير مترجمة. يؤدون وظائف تنظيمية ومساعدة ، على سبيل المثال ، ضمان هبوط الريبوسوم على mRNA.
تشكل التسلسلات غير المترجمة والمشفرة وحدة نسخ - منطقة DNA منسوخة ، أي منطقة DNA يتم تصنيع mRNA منها.
المنهيمنطقة غير منسوخة من الحمض النووي في نهاية الجين حيث يتوقف تخليق الحمض النووي الريبي.
في بداية الجين هو المنطقة التنظيمية، الذي يتضمن المروجينو المشغل أو العامل.
المروجين- التسلسل الذي يرتبط به البوليميراز أثناء بدء النسخ. المشغل أو العامل- هذه هي المنطقة التي يمكن أن ترتبط بها بروتينات خاصة - القامعين، والتي يمكن أن تقلل من نشاط تخليق الحمض النووي الريبي من هذا الجين - بمعنى آخر ، تقليله التعبير.
هيكل الجينات في بدائيات النوى
لا تختلف الخطة العامة لهيكل الجينات في بدائيات النوى وحقيقيات النوى - كلاهما يحتوي على منطقة تنظيمية مع مروج ومشغل ، ووحدة نسخ مع تسلسلات مشفرة وغير مترجمة ، ونهائي. ومع ذلك ، فإن تنظيم الجينات في بدائيات النوى وحقيقيات النوى مختلف.

أرز. 18. مخطط بنية الجين في بدائيات النوى (البكتيريا) -يتم تكبير الصورة
في بداية ونهاية المشغل ، هناك مناطق تنظيمية مشتركة للعديد من الجينات الهيكلية. من المنطقة المنسوخة من الأوبون ، يُقرأ جزيء mRNA واحد ، والذي يحتوي على العديد من سلاسل الترميز ، ولكل منها كودون البداية والتوقف الخاص به. من كل من هذه المجالاتيتم تصنيع بروتين واحد. في هذا الطريق، يتم تصنيع العديد من جزيئات البروتين من جزيء i-RNA واحد.
تتميز بدائيات النوى بمزيج من عدة جينات في وحدة وظيفية واحدة - أوبرون. يمكن تنظيم عمل الأوبرون بواسطة جينات أخرى ، والتي يمكن إزالتها بشكل ملحوظ من الأوبرون نفسه - المنظمين. يسمى البروتين المترجم من هذا الجين كاظمة. إنه ملزم بمشغل المشغل ، وينظم التعبير عن جميع الجينات الموجودة فيه مرة واحدة.
تتميز بدائيات النوى أيضًا بالظاهرة تصريفات النسخ والترجمة.

أرز. 19- ظاهرة اقتران النسخ والترجمة في بدائيات النوى- يتم تكبير الصورة
لا يحدث هذا الاقتران في حقيقيات النوى بسبب وجود غلاف نووي يفصل السيتوبلازم ، حيث تحدث الترجمة ، عن المادة الجينية التي يحدث النسخ عليها. في بدائيات النوى ، أثناء تخليق RNA على قالب DNA ، يمكن للريبوسوم أن يرتبط فورًا بجزيء RNA المركب. وهكذا ، تبدأ الترجمة حتى قبل اكتمال النسخ. علاوة على ذلك ، يمكن للعديد من الريبوسومات أن ترتبط في وقت واحد بجزيء واحد من الحمض النووي الريبي ، وتوليف عدة جزيئات من بروتين واحد في وقت واحد.
هيكل الجينات في حقيقيات النوى
جينات وكروموسومات حقيقيات النوى منظمة بشكل معقد للغاية.
تحتوي البكتيريا في العديد من الأنواع على كروموسوم واحد فقط ، وفي جميع الحالات تقريبًا توجد نسخة واحدة من كل جين على كل كروموسوم. فقط عدد قليل من الجينات ، مثل جينات الرنا الريباسي ، موجودة في نسخ متعددة. تشكل الجينات والتسلسلات التنظيمية تقريبًا جينوم بدائيات النوى بأكمله. علاوة على ذلك ، يتوافق كل جين تقريبًا بشكل صارم مع تسلسل الحمض الأميني (أو تسلسل الحمض النووي الريبي) الذي يشفره (الشكل 14).
التنظيم الهيكلي والوظيفي للجينات حقيقية النواة أكثر تعقيدًا. جلبت دراسة الكروموسومات حقيقية النواة ، وبعد ذلك التسلسل الكامل للجينوم حقيقيات النوى ، العديد من المفاجآت. تتمتع العديد من الجينات حقيقية النواة ، إن لم يكن معظمها ، بميزة مثيرة للاهتمام: تحتوي تسلسلات النيوكليوتيدات الخاصة بها على واحد أو أكثر من مناطق الحمض النووي التي لا تكوّد تسلسل الأحماض الأمينية لمنتج متعدد الببتيد. تعطل هذه الإدخالات غير المترجمة المراسلات المباشرة بين تسلسل النيوكليوتيدات للجين وتسلسل الأحماض الأمينية لبولي ببتيد المشفر. تسمى هذه الأجزاء غير المترجمة في الجينات الإنترونات، أو مدمج تسلسل، ومقاطع الترميز exons. في بدائيات النوى ، فقط عدد قليل من الجينات تحتوي على إنترونات.
لذلك ، في حقيقيات النوى ، لا يوجد عمليًا أي مزيج من الجينات في أوبرا ، وغالبًا ما يتم تقسيم تسلسل تشفير الجين حقيقي النواة إلى مناطق مترجمة. - اكسونات، والأقسام غير المترجمة - الإنترونات.
في معظم الحالات ، لم يتم إنشاء وظيفة introns. بشكل عام ، حوالي 1.5٪ فقط من الحمض النووي البشري "مشفر" ، أي أنه يحمل معلومات عن البروتينات أو الحمض النووي الريبي. ومع ذلك ، مع الأخذ في الاعتبار الإنترونات الكبيرة ، اتضح أن 30 ٪ من الحمض النووي البشري يتكون من جينات. نظرًا لأن الجينات تشكل نسبة صغيرة نسبيًا من الجينوم البشري ، فلا يزال هناك قدر كبير من الحمض النووي في عداد المفقودين.

أرز. 16. مخطط بنية الجين في حقيقيات النوى - يتم تكبير الصورة
من كل جين ، يتم تصنيع الجين غير الناضج ، أو ما قبل RNA ، والذي يحتوي على كل من الإنترونات والإكسونات.
بعد ذلك ، تتم عملية التضفير ، ونتيجة لذلك يتم استئصال مناطق intron ، ويتم تكوين mRNA الناضج ، والذي يمكن من خلاله تصنيع البروتين.

أرز. 20. عملية الربط البديلة- يتم تكبير الصورة
يسمح مثل هذا التنظيم للجينات ، على سبيل المثال ، عندما يمكن تصنيع أشكال مختلفة من البروتين من جين واحد ، نظرًا لحقيقة أنه يمكن دمج الإكسونات في تسلسلات مختلفة أثناء التضفير.

أرز. 21. الاختلافات في بنية جينات بدائيات النوى وحقيقيات النوى - يتم تكبير الصورة
الطفرات والطفرات
طفرهيسمى التغيير المستمر في التركيب الجيني ، أي تغيير في تسلسل النوكليوتيدات.
تسمى العملية التي تؤدي إلى الطفرة الطفرات، والكائن الحي الكلالتي تحمل خلاياها نفس الطفرة متحولة.
نظرية الطفرةصاغها هيو دي فريس لأول مرة في عام 1903. تتضمن نسخته الحديثة الأحكام التالية:
1. تحدث الطفرات فجأة وفجأة.
2. تنتقل الطفرات من جيل إلى جيل.
3. يمكن أن تكون الطفرات مفيدة أو ضارة أو محايدة أو مسيطرة أو متنحية.
4. تعتمد احتمالية اكتشاف الطفرات على عدد الأفراد المدروسة.
5. يمكن أن تحدث طفرات مماثلة بشكل متكرر.
6. لا يتم توجيه الطفرات.
يمكن أن تحدث الطفرات تحت تأثير عوامل مختلفة. يميز بين الطفرات التي تسببها مطفر التأثيرات: الفيزيائية (مثل الأشعة فوق البنفسجية أو الإشعاعية) ، والمواد الكيميائية (مثل الكولشيسين أو أنواع الأكسجين التفاعلية) والبيولوجية (مثل الفيروسات). يمكن أن تحدث الطفرات أيضًا أخطاء النسخ المتماثل.
اعتمادا على شروط ظهور الطفرات تنقسم إلى من تلقاء نفسها- أي الطفرات التي نشأت في ظل الظروف العادية ، و الناجم عن- أي الطفرات التي نشأت في ظل ظروف خاصة.
يمكن أن تحدث الطفرات ليس فقط في الحمض النووي النووي ، ولكن أيضًا ، على سبيل المثال ، في الحمض النووي للميتوكوندريا أو البلاستيدات. وفقًا لذلك ، يمكننا التمييز نوويو السيتوبلازمالطفرات.
نتيجة لحدوث الطفرات ، يمكن أن تظهر ألائل جديدة في كثير من الأحيان. إذا تجاوز الأليل الطافر الأليل الطبيعي ، تسمى الطفرة مهيمن. إذا قام الأليل الطبيعي بقمع الطفرة ، يتم استدعاء الطفرة الصفة الوراثية النادرة. معظم الطفرات التي تؤدي إلى ظهور أليلات جديدة تكون متنحية.
تتميز الطفرات بالتأثير تكيفية، مما يؤدي إلى زيادة قدرة الكائن الحي على التكيف مع البيئة ، حياديالتي لا تؤثر على البقاء ضارالتي تقلل من قدرة الكائنات الحية على التكيف مع الظروف البيئية و قاتلةمما يؤدي إلى موت الكائن الحي في المراحل الأولى من تطوره.
وفقا للنتائج ، تتميز الطفرات التي تؤدي إلى فقدان وظيفة البروتين، الطفرات التي تؤدي إلى ظهور البروتين له وظيفة جديدة، وكذلك الطفرات التي تغيير جرعة الجين، وبالتالي جرعة البروتين المصنعة منه.
يمكن أن تحدث طفرة في أي خلية من خلايا الجسم. إذا حدثت طفرة في خلية جرثومية ، يتم استدعاؤها جرثومية(جرثومي أو توليدي). لا تظهر مثل هذه الطفرات في الكائن الحي الذي ظهرت فيه ، ولكنها تؤدي إلى ظهور طفرات في النسل وتكون موروثة ، لذا فهي مهمة لعلم الوراثة والتطور. إذا حدثت الطفرة في أي خلية أخرى ، يتم استدعاؤها جسدي. يمكن أن تظهر مثل هذه الطفرة إلى حد ما في الكائن الحي الذي نشأت فيه ، على سبيل المثال ، تؤدي إلى تكوين أورام سرطانية. ومع ذلك ، فإن هذه الطفرة ليست وراثية ولا تؤثر على النسل.
يمكن أن تؤثر الطفرات على أجزاء من الجينوم بأحجام مختلفة. تخصيص وراثي, الكروموسوماتو الجينومالطفرات.
الطفرات الجينية
تسمى الطفرات التي تحدث على مقياس أصغر من جين واحد وراثي، أو منقط (منقط). تؤدي هذه الطفرات إلى تغيير واحد أو أكثر من النيوكليوتيدات في التسلسل. تشمل الطفرات الجينيةبدائل، مما يؤدي إلى استبدال أحد النوكليوتيدات بآخر ،الحذفمما يؤدي إلى فقدان أحد النيوكليوتيدات ،الإدخالات، مما يؤدي إلى إضافة نيوكليوتيد إضافي إلى التسلسل.

أرز. 23. الطفرات الجينية (النقطية)
وفقًا لآلية العمل على البروتين ، تنقسم الطفرات الجينية إلى:مرادف، والتي (نتيجة لانحلال الكود الجيني) لا تؤدي إلى تغيير في تكوين الأحماض الأمينية لمنتج البروتين ،الطفرات المغلوطة، مما يؤدي إلى استبدال أحد الأحماض الأمينية بآخر ويمكن أن يؤثر على بنية البروتين المركب ، على الرغم من عدم أهميته في كثير من الأحيان ،طفرات لا معنى لها، مما أدى إلى استبدال كود الترميز برمز التوقف ،الطفرات التي تؤدي إلى اضطراب التضفير:

أرز. 24. مخططات الطفرة
أيضًا ، وفقًا لآلية العمل على البروتين ، يتم عزل الطفرات المؤدية إلى تحول الإطار قراءة٪ sمثل عمليات الإدراج والحذف. مثل هذه الطفرات ، مثل الطفرات غير المنطقية ، على الرغم من حدوثها في نقطة واحدة في الجين ، غالبًا ما تؤثر على البنية الكاملة للبروتين ، مما قد يؤدي إلى تغيير كامل في بنيته.
أرز. 29. الكروموسوم قبل وبعد الازدواجية
الطفرات الجينومية
أخيرا، الطفرات الجينيةيؤثر على الجينوم بأكمله ، أي عدد الكروموسومات يتغير. يتميز تعدد الصبغيات - زيادة في تعدد الصبغيات في الخلية ، واختلال الصيغة الصبغية ، أي تغيير في عدد الكروموسومات ، على سبيل المثال ، التثلث الصبغي (وجود متماثل إضافي في أحد الكروموسومات) و monosomy (غياب متماثل في الكروموسوم).
فيديو متعلق بالحمض النووي
استنساخ الحمض النووي ، ترميز الحمض النووي الريبي ، تخليق البروتين
بلوك 2. DNA. الأسئلة 5،6،7.
هيكل الحمض النووي. نموذج من J. Watson و F. Crick. خصائص ووظائف المواد الوراثية.
التكاثر الذاتي للمادة الوراثية. تكرار الحمض النووي.
تنظيم المواد الوراثية في بدائيات النواة وحقيقيات النوى. تصنيف متواليات النوكليوتيدات في جينوم حقيقيات النوى (فريد ، متكرر باعتدال ، متكرر للغاية).
في عام 1868 ، اكتشف الكيميائي السويسري F. Miescher في نواة الخلية المعزولة من القيح ، وبعد ذلك من الحيوانات المنوية للسلمون ، مادة أطلق عليها اسم "nuclein" (من النواة اللاتينية - النواة). بعد ذلك ، ذكر R. Altmann (1889) أن "النوكلين" المعزول بواسطة F. Miescher يتكون من جزأين - البروتين والأحماض النووية. الأحماض النووية ، مثل البروتينات ، لها بنية أولية (بمعنى تسلسل النوكليوتيدات) وهيكل ثلاثي الأبعاد. تكثف الاهتمام ببنية الحمض النووي في بداية القرن العشرين. كان هناك افتراض أن الحمض النووي، ربما مادة وراثية. في عام 1952 ، اكتشف Chargaff قاعدة التكامل ، والتي سميت فيما بعد على اسم الخالق. يكمن في حقيقة أن:
- كمية الأدينين تساوي كمية الثايمين ، والجوانين يساوي السيتوزين: A = T ، G = C.
- عدد البيورينات يساوي عدد البيريميدينات: A + G = T + C.
- عدد القواعد مع المجموعات الأمينية في الموضع 6 يساوي عدد القواعد مع مجموعات كيتو في الموضع 6: A + C = G + T.
بعد ذلك ، حصل ويلكينسون على صورة بالأشعة السينية للحمض النووي. وبعد ذلك بقليل ، اقترح Watson and Crick في عام 1953 نموذجهم الخاص للحمض النووي ، والذي حصل مع ويلكينسون على جائزة نوبل في عام 1962.
المبادئ الأساسية لبنية الحمض النووي.
1. أحادي نيوكليوتيد الدنا يتكون من قاعدة نيتروجينية ، ديوكسيريبوز ، وبقايا حمض الفوسفوريك. يمكن أن تكون القواعد النيتروجينية البيورين A ، G أو بيريميدينج ، ت.
2. ترتبط القواعد النيتروجينية بذرة الكربون C1 في جزيء البنتوز ، ويرتبط الفوسفات بـ C5. تحتوي الذرة الثالثة دائمًا على مجموعة هو.
3. عندما يتفاعل فوسفات أحد النوكليوتيدات مع هيدروكسيل الديوكسيريبوز للآخر ، رابطة الفوسفوديستر.
4. يحدث اتصال النيوكليوتيدات من خلال OH للبنتوز بالموضع C3 وفوسفات النيوكليوتيدات اللاحقة.
5. الحمض النووي عبارة عن سلسلة مزدوجة من عديد النوكليوتيدات. ترتبط سلسلتان من عديد النوكليوتيدات بواسطة روابط هيدروجينية مبدأ المجاملة A-T و G-C. يوجد رابطان هيدروجين بين A و T وثلاثة روابط هيدروجينية بين T و C.
6. عدم التوازي.الطرف الخامس لسلسلة واحدة متصل بالطرف الثالث للسلسلة الأخرى.
7. يبلغ قطر حلزون DNA 2 نانومتر ، وطول الملعب 3.4 نانومتر. يوجد 10 أزواج أساسية لكل دور.
8. الهيكل الأساسي- سلسلة عديد النوكليوتيدات.
الهيكل الثانوي- سلسلتان متكاملتان من عديد النوكليوتيدات.
الهيكل الثالث- حلزوني ثلاثي الأبعاد.
9. الحمض النووي لديه القدرة على التكاثر.
تكرار.

1 - سلاسل قوالب الحمض النووي ؛ 2 - إنزيم هيليكاز ، يفصل سلاسل DNA المصفوفة ؛ 3 - بروتينات DSB التي تمنع لم شمل سلاسل الحمض النووي ؛ 4 - بريماز 5 - أساس RNA (تم تصنيعه بواسطة RNA polymerase - primase) ؛ 6 - سلاسل ابنة توليف بوليميراز DNA ؛ 7 - حبلا ابنة قيادية من الحمض النووي ؛ 8 - ligase يربط شظايا Okazaki من خيط DNA المتأخر ؛ 9 - شظية أوكازاكي (150-200 نيوكليوتيد) ؛ 10 - توبويزوميراز
يتم توليف جزيء DNA الجديد بطريقة شبه محافظة. هذا يعني أن الجزيء الابنة سيحتوي على أحد الوالدين وخيط واحد مركب حديثًا. نظرًا لأن تخليق الحمض النووي يحدث على قالب أحادي السلسلة ، فإنه يسبقه فصل مؤقت إلزامي بين الخيطين ، مع تكوين شوكة النسخ المتماثل. باستخدام المجهر الإلكتروني ، وجد أن منطقة التكرار لها مظهر العين داخل الحمض النووي غير المتماثل (عين النسخ تتكون من حوالي 300 نيوكليوتيد).
ريبليكون- جزء الحمض النووي من نقطة أصل النسخ المتماثل إلى نقطة انتهائه.
لفك حلزون الحمض النووي ، إنزيمات خاصة (بروتينات).تشارك عدة إنزيمات في النسخ المتماثل ، كل منها يؤدي وظيفته الخاصة.
هليكازات الحمض النووي (هليكازات)كسر روابط الهيدروجين بين القواعد ، وتقسيم الخيوط ، ودفع شوكة النسخ المتماثل.
البروتينات المزعزعة للاستقرارسلاسل عقد.
الحمض النووي هو توبويزوميراز. تذكر أن الحمض النووي هو حلزون.وفقًا لذلك ، لكي تتحرك الشوكة للأمام ، يجب أن ينفخ اللولب بسرعة. لكن هذا سيتطلب خسارة كبيرة في الطاقة. في الواقع ، هذا ما زال لم يحدث. يتم تسهيل ذلك عن طريق DNA topoisomerases. إنها تقدم فواصل مفردة ومزدوجة في السلسلة ، مما يسمح للسلاسل بالانفصال ، ثم القضاء على هذه الفواصل. بفضل أحد خيوط الحمض النووي تبدأ في الدوران حول الخيط الثاني. كما أنهم يشاركون في فك اقتران الحلقات المتكونة أثناء تكرار الحمض النووي الدائري.
يحدث تخليق خيوط الحمض النووي بمساعدة بوليميريز الحمض النووي.لكن هذا الإنزيم له خصوصية. إنه قادر على إضافة نيوكليوتيدات إلى الطرف الثالث من سلسلة موجودة. تسمى هذه الدائرة مسبقة التشكيل بذرة،الذي يصنع بريماز.يختلف RNA التمهيدي عن بقية خيوط الحمض النووي لأنه يحتوي على الريبوز. حجم البذرة صغير. تتم إزالة البذرة التي أدت وظيفتها بواسطة إنزيم خاص ، ويتم القضاء على الفجوة المتكونة في هذه الحالة. بوليميريز الحمض النووي(في هذه الحالة ، بدلاً من البذرة ، يستخدم الطرف 3OH لجزء الحمض النووي المجاور).
يفترض تكرار الحمض النووي أن تخليق خيطين يحدث في وقت واحد. لكن في الواقع ، الأمور لا تسير على هذا النحو تمامًا. تذكر تلك السلاسل متوازية.ويمكن أن يحدث تخليق سلسلة جديدة فقط في الاتجاه من النهاية 5 إلى النهاية 3. لذلك ، يحدث التوليف المستمر فقط على سلسلة واحدة (رائدة).في الثانية (متخلفة) يحدث في شظايا أوكازاكي. يتم تصنيع كل جزء باستخدام مادة أولية من الحمض النووي الريبي. ثم تتم إزالة المواد الأولية ، وتملأ الفجوات ببوليميراز الحمض النووي ، ويتم ربط الأجزاء المتقاطعة بإنزيم. يجاز .
التنظيم الهيكلي والوظيفي للحمض النووي في الكائنات الأولية وحقيقيات النوى
ادرس الجداول وانسخها في مصنف.
اقرأ:
|
يتم ضمان الوراثة والتنوع من خلال عمل ركيزة مادية خاصة - جهاز وراثي.
في المرحلة الحالية ، تجعل الأفكار حول الطبيعة من الممكن التمييز المستويات التالية من التنظيم الهيكلي والوظيفي للمواد الوراثية:
الجين.
الكروموسومات.
الجينوم.
الهيكل الأساسي المستوى الجينيالمنظمة الجين. الجينات مستقلة نسبيًا عن بعضها البعض ، لذا فإن الميراث المنفصل (المنفصل) والمستقل (قانون مندل الثالث) والتغيرات (الطفرات) في السمات الفردية ممكنة.
توجد جينات الخلايا حقيقية النواة في الكروموسومات، توفير مستوى الكروموسومتنظيم المواد الوراثية. تشكل الجينات الموجودة على نفس الكروموسوم مجموعة ارتباط وعادة ما تنتقل معًا. هذا المستوى من التنظيم هو شرط ضروري لربط الجينات وإعادة توزيع الجينات الأبوية في النسل أثناء التكاثر الجنسي (العبور والتباعد العشوائي للكروموسومات والكروماتيدات إلى القطبين أثناء الانقسام الاختزالي).
تتصرف المجموعة الكاملة من جينات الكائن الحي وظيفيًا ككل وتشكل نظامًا واحدًا يسمى الطراز العرقى (الجينوم). يمكن أن يتجلى نفس الجين في الأنماط الجينية المختلفة بطرق مختلفة. المستوى الجينوميتشرح المنظمة التفاعل داخل الأليلات وفيما بينها للجينات الموجودة على نفس الكروموسومات وعلى الكروموسومات المختلفة.
المصطلح " الجينوم " يعني التركيب الكامل للحمض النووي للخلية ، أي مجموع جميع الجينات والمناطق الجينية.
تنظيم الجينوم البشري(مثل كل الأنواع حقيقية النواة) التسلسل الهرمي المتسلسل للعناصر:
النيوكليوتيدات.
الجينات ذات المناطق الجينية ؛
جينات معقدة
أذرع الكروموسومات
الكروموسومات.
مجموعة Haploid جنبًا إلى جنب مع الحمض النووي خارج النواة.
في أوائل الخمسينيات من القرن الماضي ، ثبت ذلك الوحدة الوظيفية الأولية للوراثة والتنوع، الذي يحدد إمكانية تطوير سمة معينة لخلية أو كائن حي ، هو الجين ، والتي لديها تنظيم هيكلي ووظيفي معين.
تطور مفهوم "الجين".عُرفت المعلومات المنفصلة عن وراثة السمات لفترة طويلة جدًا ، ولكن تم تحديد أنماط انتقالها لأول مرة بواسطة G.Mendel في عام 1865 في عمله: "تجارب على النباتات الهجينة". لم يعلق المعاصرون أهمية على اكتشافه. لم يكن مفهوم "الجين" موجودًا بعد في ذلك الوقت ، وتحدث جي مندل عن "الميول الوراثية" الموجودة في الخلايا الجرثومية ، والتي كانت طبيعتها غير معروفة.
في عام 1900 بشكل مستقل دي فريس (هولندا) وإي. سيرماك (النمسا) وك. كورينز (ألمانيا)أعاد اكتشاف القوانين جي مندل. يعتبر هذا العام عام ميلاد علم الوراثة كعلم. في عام 1902 T. Boveri ، E. Wilson و D. Settonاقترح علاقة العوامل الوراثية بالكروموسومات. في عام 1906 دبليو باتسونصاغ مصطلح "علم الوراثة" ، وفي عام 1909 في جوهانسن- "الجين". في عام 1911 تي مورجانوصاغ الموظفون الأحكام الرئيسية لنظرية الكروموسوم في الوراثة.
في بداية القرن العشرين. سيطرت فكرة استقرار الجينات وثباتها ( أ. وايزمان ، دبليو باتسون) ، وإذا حدثت تغييرات ( جي دي فريس) ، ثم بشكل عفوي ، بغض النظر عن تأثير البيئة. تم دحض هذه الفكرة الخاطئة من خلال الحصول على الطفرات المستحثة ج.أ.نادسون وج.س.فيليبوف(1925) على الفطر ، جي ميلر(1927) على ذبابة الفاكهة و انا. ستادلر(1928) على الذرة.
في الوقت نفسه ، كانت هناك فكرة عن عدم قابلية الجين للتجزئة. ومع ذلك ، في أواخر الخمسينيات من القرن الماضي ، تبين أن الجين هو وحدة منفصلة. عند أداء الوظيفة الرئيسية - برمجة تخليق البروتين - يعمل الجين كوحدة متكاملة ، يؤدي تغييرها إلى إعادة ترتيب بنية جزيء البروتين. دعا Benzer هذه الوحدة cistronome. في الحجم ، يساوي تقريبًا الجين. تكمن سرية الجين في وجود وحدات فرعية فيه. تسمى الوحدة الأولية للتغير الجيني ، وحدة الطفرة لحم الخنزير، ووحدة إعادة التركيب (تبادل أقسام الكروموسومات المتجانسة في طور الانقسام الاختزالي الأول) هي ريكون. الحد الأدنى من أحجام لحم الضأن وريكون يساوي زوجًا واحدًا من النيوكليوتيدات. حاليًا ، يعتبر زوج من النيوكليوتيدات الوحدة الهيكلية الأولية للجين ، ويعتبر الكودون وحدة وظيفية.
في عشرينيات القرن الماضي ، وجد أن الكروموسومات تتكون من البروتين والأحماض النووية. في عام 1928 ن. كولتسوفاقترح أن وظائف الجينات تؤديها جزيئات البروتين ، والبروتينات قادرة على التكاثر الذاتي. ومع ذلك ، فقد ثبت فيما بعد أن الناقل للمعلومات الجينية هو جزيء الحمض النووي.
في هذا الطريق ، الجينهي وحدة هيكلية من الأحماض النووية (عديد النيوكليوتيدات) المسؤولة عن تخزين ونقل وتنفيذ المعلومات الجينية. تحت مصطلح " الجين " يمكن للمرء أن يفهم تسلسل النيوكليوتيدات في الحمض النووي ، والذي يحدد وظيفة معينة (وحدة شكلية ، فسيولوجية ، كيميائية حيوية ، مناعية ، إكلينيكية ، وأي تمييز آخر) في الجسم. الجين يمثل الحد الأدنى من المواد الوراثية ،وهو أمر ضروري لتخليق t-RNA أو r-RNA أو الببتيد مع خصائص معينة. وفقا للأفكار الحديثة ، الجين- هذا جزء من جزيء DNA يوفر معلومات عن تخليق بولي ببتيد معين أو حمض نووي.
يوجد أكثر من 30000 جين في الجينوم البشري. يختلف حجم الجينات البشرية بشكل كبير ، لكن معظمها يصل إلى 50000 زوج قاعدي. يتم تحقيق نقل الجينات في سلسلة من الأجيال من الخلايا أو الكائنات الحية الخلافة المادية- وراثة الصفات من الأبوين عن طريق الأبناء.
خصائص الجينات.تتميز الجينات بخصائص معينة:
Ø الخصوصية (لكل جين هيكلي ترتيب خاص به من النيوكليوتيدات ويحدد تركيب عديد ببتيد معين) ،
Ø النزاهة (عند برمجة تخليق بولي ببتيد ، يعمل الجين كوحدة غير قابلة للتجزئة) والتمييز (وجود الوحدات الفرعية) ،
Ø الاستقرار (مستقر نسبيًا) والقدرة (القدرة على التحول) ،
Ø تعدد الأشكال (قد يكون أحد الجينات مسؤولاً عن ظهور عدة سمات) ،
Ø التعبيرية (درجة المظاهر المظهرية) والاختراق (تكرار التعبير الجيني).
يتم تحديد الخصائص الرئيسية للجين كوحدة وظيفية لمادة الوراثة والتنوع من خلال خصائصه التنظيم الكيميائي .
هيكل الجين عبارة عن مجموعة من الكودونات تتكون من ثلاثة نيوكليوتيدات (رمز ثلاثي). يحتوي الجين على معلومات حول بنية البروتين ، ويحتوي كل كودون على معلومات حول بنية الحمض الأميني وموقعه في جزيء البروتين.
من المعروف الآن أن الجين له بنية داخلية معقدة ، والأقسام الفردية لها وظائف مختلفة. في الجين ، يمكن تمييز الجزء الأكبر ، والذي يحدد في الواقع بنية البولي ببتيد. يُطلق على هذا الجزء اسم "الكيسترون" ويمكن أن يصل طوله إلى عشرات الآلاف من أزواج القواعد. تحتوي بعض الجينات على عدة سيسترونات (جينات متعددة الكريات أو جينات بنيوية). أظهرت الدراسات أن حجم الجين أكبر من حجم عديد الببتيد. ومن هنا استنتاج أن الجين يحتوي على متواليات نيوكليوتيد لا تؤثر على بنية البولي ببتيد ، ولكنها ضرورية للتشغيل الصحيح للجزء الهيكلي (الجين الهيكلي). هذا هو الجزء التنظيمي من الجين (أو مشغل الجينات). يتحكم جين المشغل في نشاط العديد من جينات الكيسترون ويقع بجوارها مباشرة. تشكل مجموعة من مجموعة الجينات الهيكلية وجين المشغل أوبرونًا. يتم أيضًا عزل الجين المنظم ، والذي ينظم نشاط المشغل بمساعدة مادة خاصة ينتجها - مثبط. القامع ، الذي يعمل على جين المشغل ، يثبطه ويقلل من نشاط السيسترونات المرتبطة به.
يتم دمج الجينات في كتل تشكل خيطًا من الحمض النووي. في الوقت نفسه ، يتم ترتيبها بترتيب خطي ، مما يحدد أيضًا البنية الشبيهة بالخيط للحمض النووي والكروموسومات.
وقد أثبتت الدراسات التي أجريت على الطبيعة الكيميائية للمادة الوراثية ذلك بشكل قاطع الركيزة المادية للوراثة والتنوع احماض نووية البوليمرات التي تتكون من مونومرات النوكليوتيدات ، بما في ذلك ثلاثة مكونات:
سكر (بنتوز) ؛
قاعدة نيتروجينية.
من بين احماض نوويةتميز نوعان من الاتصالات:
حمض ديوكسي ريبونوكلييك (دنا) ؛
حمض الريبونوكليك (RNA).
الحمض النووي هو المسؤول عن المعلومات الوراثية في جميع خلايا الكائنات الأولية وحقيقيات النوى (في الفيروسات ، يمكن أيضًا تنفيذ هذه الوظيفة بواسطة جزيء RNA) ؛ ينقل الحمض النووي الريبي المعلومات الجينية وينفذها.
حمض الديوكسي ريبونوكلييك (DNA)- مكون أكثر استقرارًا كيميائيًا ، ركيزة الوراثة والتنوع.
تم فك شفرة هيكل جزيء الحمض النووي جي واتسون ، إف كريك و إم ويلكينزفي عام 1953. حسب النموذج واتسون وإف كريك، جزيء الحمض النووي عبارة عن سلسلتين ثابتتين بشكل صارم متوازيتين مع بعضهما البعض وملفوفان في حلزون مزدوج ومضاد متوازي (مقابل الطرف 3 "لسلسلة واحدة هو 5" نهاية الطرف الآخر) سلاسل عديد النوكليوتيد ، والتي تشكل روابطها النيوكليوتيدات.
أولاً ، يجب أن تكون المادة الجينية قادرة على التكاثر الذاتي من أجل في عملية الاستنساخ ، نقل المعلومات الوراثية ، والتي على أساسها سيتم تكوين جيل جديد. ثانيًا ، من أجل ضمان استقرار الخصائص في عدد من الأجيال ، يجب أن تحافظ المادة الوراثية على ثبات تنظيمها. ثالثًا ، يجب أن تكون مادة الوراثة والتنوع قادرة على اكتساب التغييرات وإعادة إنتاجها ، مما يجعل من الممكن التطور التاريخي للمادة الحية في ظل الظروف المتغيرة. فقط إذا استوفت المتطلبات المحددة ، يمكن أن تضمن الركيزة المادية للوراثة والتنوع مدة واستمرارية وجود الطبيعة الحية وتطورها.
تتيح الأفكار الحديثة حول طبيعة الجهاز الجيني التمييز بين ثلاثة مستويات من تنظيمه: الجين والكروموسومات والجينوم. في كل منها ، تتجلى الخصائص الرئيسية لمادة الوراثة والتنوع وأنماط معينة من انتقالها وعملها.
من بين الأحماض النووية ، هناك نوعان من المركبات المميزة: أحماض ديوكسي ريبونوكلييك (DNA) وأحماض ريبونوكلييك (RNA). وجدت دراسة تركيبة الناقلات الرئيسية للمواد الوراثية - الكروموسومات - أن أكثر مكوناتها استقرارًا كيميائيًا هو الحمض النووي ، وهو ركيزة الوراثة والتنوع. هيكل الحمض النووي. نموذج بواسطة J. Watson و F. Crick
يتكون الحمض النوويمن النيوكليوتيدات التي تشمل السكر - الديوكسيريبوز ، الفوسفات وأحد القواعد النيتروجينية - البيورين (الأدينين أو الجوانين) أو البيريميدين (الثايمين أو السيتوزين). ومن سمات التنظيم الهيكلي للحمض النووي أن جزيئاته تشتمل على سلسلتين عديد النوكليوتيد مترابطتين في طريق. وفقًا لنموذج الحمض النووي ثلاثي الأبعاد المقترح في عام 1953 من قبل الفيزيائي الأمريكي ج. الأدينين من سلسلة واحدة متصل برابطتين هيدروجينيتين مع ثايمين لسلسلة أخرى ، وتتكون ثلاث روابط هيدروجينية بين الجوانين والسيتوزين من سلاسل مختلفة. يوفر هذا الاتصال للقواعد النيتروجينية اتصالًا قويًا بين السلسلتين ويحافظ على مسافة متساوية بينهما طوال الوقت. تتمثل الوظيفة الرئيسية للحمض النووي في أنه مصمم لتخزين ونقل المعلومات الوراثية في الخلايا الأولية وحقيقية النواة. في الفيروسات ، يتم تنفيذ هذه الوظيفة بواسطة RNA.NK. هيكل وهيكل الحمض النووي. خصائص الحمض النووي.
1. الاستقرار. يتم توفيره عن طريق روابط الهيدروجين والجليكوسيد والفوسفودايستر ، وكذلك من خلال آلية إصلاح الأضرار التلقائية والمستحثة ؛
2. القدرة على التكرار. بسبب هذه الآلية ، يتم الحفاظ على العدد ثنائي الصبغيات من الكروموسومات في الخلايا الجسدية. من الناحية التخطيطية ، يتم عرض جميع ميزات الحمض النووي المدرجة كجزيء جيني في الشكل.
3. وجود كود جيني.يتم تحويل التسلسل الأساسي في الحمض النووي من خلال عمليات النسخ والترجمة إلى تسلسل الأحماض الأمينية في سلسلة البولي ببتيد ؛
4. القدرة على إعادة التركيب الجيني. بفضل هذه الآلية ، يتم تشكيل مجموعات جديدة من الجينات المرتبطة.
بصلح- وظيفة خاصة للخلايا ، والتي تتمثل في القدرة على تصحيح الضرر الكيميائي وكسر جزيئات الحمض النووي التالفة أثناء التخليق الحيوي الطبيعي للحمض النووي في الخلية أو نتيجة التعرض لعوامل فيزيائية أو كيميائية. يتم تنفيذه بواسطة أنظمة إنزيمية خاصة للخلية. يرتبط عدد من الأمراض الوراثية (مثل جفاف الجلد المصطبغ) بأنظمة الإصلاح الضعيفة.
تكرار الحمض النووي- عملية تخليق الجزيء الابنة لحمض deoxyribonucleic على مصفوفة جزيء DNA الأصل. أثناء الانقسام اللاحق للخلية الأم ، تتلقى كل خلية ابنة نسخة واحدة من جزيء DNA مطابق للحمض النووي للخلية الأم الأصلية. تضمن هذه العملية النقل الدقيق للمعلومات الجينية من جيل إلى جيل. يتم إجراء تكاثر الحمض النووي بواسطة مركب إنزيمي معقد ، يتكون من 15-20 بروتينًا مختلفًا ، يُطلق عليه اسم ريبليزوم.
الكود الجيني- هذا سجل في المناطق الفريدة لجزيء الحمض النووي للمعلومات حول بنية البروتينات وعديد الببتيدات. اقترح كريك وزملاؤه أنه يجب التعبير عن المعلومات من خلال الكتل - الكودونات. اقترحوا أن تحتوي الكودونات على 3 نيوكليوتيدات على الأقل. لماذا؟ في الطبيعة ، تم العثور على 20 نوعًا من الأحماض الأمينية المختلفة ، والتي يتم استكمال جميع البروتينات منها. من أجل تشفير 20 نوعًا من الأحماض الأمينية ، يجب أن تتضمن الشفرة الوراثية 3 نيوكليوتيدات على الأقل ، لأن من أصل اثنين من النيوكليوتيدات ، يمكن دمج 4 = 16 خيارًا فقط ، ومن بين ثلاثة نيوكليوتيدات - 43 = 64 خيارًا .. تم تنفيذ فك تشفير كامل للشفرة الجينية في الستينيات من القرن العشرين. اتضح أنه من بين 64 متغيرًا محتملاً من ثلاثة توائم ، هناك 61 نوعًا من الأحماض الأمينية المختلفة ، و 3 لا معنى لها ، أو أكواد STOP: أكواد UAG ، UAA ، UGA ، حيث تتوقف قراءة المعلومات الوراثية (الشكل 4.6).
خصائص الكود الجيني
1. ثلاثية: كل كودون يحتوي على 3 نيوكليوتيدات ^
2. العالمية: جميع الكائنات الحية الموجودة على الأرض لها نفس الشفرة الوراثية ، مما يشير إلى وحدة أصل جميع الكائنات الحية. يشفر كودون AGA الحمض الأميني أرجينين في البكتيريا والبشر وجميع الكائنات الحية.
3. الانحطاط. 61 ثلاثة توائم لكل 20 حمض أميني. ويترتب على ذلك أنه يجب تشفير بعض الأحماض الأمينية بعدة توائم. هذا مهم جدًا لأن استبدال النوكليوتيدات قد لا يؤدي دائمًا إلى استبدال الأحماض الأمينية). على سبيل المثال ، يتم ترميز حمض أميني فالين بثلاثة توائم: GTT ، GTC ، GTA ، GTG.
4. الخصوصية: كل ثلاثة توائم يتوافق مع حمض أميني واحد فقط: GTT-only valine. كودون ATG هو كودون البدء (ميثيونين).
5. العالمية: جميع الكائنات الحية الموجودة على الأرض لها نفس الشفرة الجينية ، مما يشير إلى وحدة أصل جميع الكائنات الحية. يشفر كودون AGA الحمض الأميني أرجينين في البكتيريا والبشر وجميع الكائنات الحية.
6. ^ الاستمرارية وعدم التداخل (قراءة بدون ثغرات).
مصفوفة ، أو معلومات ، الحمض النووي الريبي (مرنا ، أو مرنا). النسخ. من أجل تخليق البروتينات بالخصائص المرغوبة ، يتم إرسال "تعليمات" إلى موقع بنائها بالترتيب الذي يتم فيه تضمين الأحماض الأمينية في سلسلة الببتيد. هذه التعليمات واردة في تسلسل النيوكليوتيدات للمصفوفة ، أو معلومات الحمض النووي الريبي (مرنا ، مرنا) المركبة في الأقسام المقابلة من الحمض النووي. تسمى عملية تخليق الرنا المرسال النسخ. يبدأ تركيب الرنا المرسال باكتشاف بوليميراز الحمض النووي الريبي لموقع خاص في جزيء الحمض النووي ، مما يشير إلى موقع بداية النسخ - المحفز. بعد التعلق بالمُحفِّز ، يقوم بوليميراز الحمض النووي الريبي بفك المنعطف المجاور لحلزون الحمض النووي. يتباعد عند هذه النقطة خيطان من الحمض النووي ، ويصنع الإنزيم على أحدهما الرنا المرسال. يحدث تجميع الريبونوكليوتيدات في سلسلة بالتوافق مع تكاملها مع نيوكليوتيدات الحمض النووي ، وأيضًا بشكل مضاد للتوازي مع سلسلة DNA النموذجية. نظرًا لحقيقة أن بوليميراز الحمض النووي الريبي قادر على تجميع بولي نيوكليوتيد فقط من الطرف 5 إلى النهاية 3 ، يمكن أن يعمل واحد فقط من خيطي DNA كقالب للنسخ ، أي الذي يواجه الإنزيم بـ 3 'end (3 "→ 5"). تسمى هذه السلسلة كودوجينيك (codogenic) ، والتوازي المضاد لاتصال سلسلتين عديد النوكليوتيد في جزيء DNA يسمح لـ RNA polymerase باختيار القالب المناسب لتخليق mRNA.
بالانتقال على طول سلسلة الحمض النووي المشفر ، يقوم بوليميراز الحمض النووي الريبي بإعادة كتابة تدريجية ودقيقة للمعلومات حتى يواجه تسلسل نوكليوتيد محدد - فاصل نسخ. في هذه المنطقة ، ينفصل RNA polymerase عن كل من قالب DNA و mRNA المركب حديثًا (الشكل 3.25). يشكل جزء من جزيء الحمض النووي ، بما في ذلك المحفز ، والتسلسل المكتوب والمُنهي ، وحدة نسخ - نسخة.
أثناء التوليف ، بينما يتحرك بوليميراز الحمض النووي الريبي على طول جزيء الحمض النووي ، يتم مرة أخرى دمج الأجزاء التي تقطعت بها السبل من الحمض النووي الذي مر من خلاله في حلزون مزدوج. يحتوي الرنا المرسال المتكون أثناء النسخ على نسخة طبق الأصل من المعلومات المسجلة في القسم المقابل من الحمض النووي. ثلاثة نيوكليوتيدات مرنا متجاورة ترمز للأحماض الأمينية تسمى الكودونات. رموز تسلسل كودون mRNA لتسلسل الأحماض الأمينية في سلسلة الببتيد. تتوافق بعض الأحماض الأمينية مع أكواد mRNA. تعمل سلسلة كودون DNA كقالب لنسخ mRNA ، حيث تواجه الإنزيم بنهايته 3. سلاسل RNA في الاتجاه 5 "→ 3" عن طريق ربط ribonucleoside gryphosphates ؛ IV - إطلاق 5 "نهاية الحمض النووي الريبي المركب واستعادة الحلزون المزدوج للحمض النووي ؛ V - نهاية تخليق الحمض النووي الريبي في منطقة النهاية ، فصل البوليميراز عن سلسلة الحمض النووي الريبي المكتملة
^ نقل الحمض النووي الريبي (الحمض النووي الريبي). إذاعة.دور مهم في عملية استخدام المعلومات الوراثية من قبل الخلية ينتمي إلى نقل الحمض النووي الريبي (الحمض الريبي النووي النقال). إيصال الأحماض الأمينية الضرورية إلى موقع تجميع سلاسل الببتيد ، يعمل الحمض الريبي النووي النقال (tRNA) كوسيط انتقالي ، وجزيئات TRNA عبارة عن سلاسل متعددة النوكليوتيد يتم تصنيعها على تسلسلات معينة من الحمض النووي. وهي تتكون من عدد صغير نسبيًا من النيوكليوتيدات -75-95. نتيجة للتوصيل التكميلي للقواعد الموجودة في أجزاء مختلفة من سلسلة البولي نوكليوتيد الحمض الريبي النووي النقال ، فإنه يكتسب هيكلًا يشبه ورقة البرسيم في الشكل. ويتكون من أربعة أجزاء رئيسية تؤدي وظائف مختلفة. يتكون "الجذع" المستقبلي من جزأين طرفيين متصلين متكاملين من الحمض الريبي النووي النقال. يتكون من سبعة أزواج أساسية. الطرف 3 بوصات من هذا الجذع أطول نوعًا ما ويشكل منطقة أحادية الجديلة تنتهي بتسلسل CCA مع مجموعة OH حرة. ويرتبط حمض أميني قابل للنقل بهذه النهاية. والفروع الثلاثة المتبقية هي متواليات نيوكليوتيدات متقاربة تكميلية تنتهي في مناطق تشكيل حلقة غير زوجية. يتكون منتصف هذه الفروع - anticodon - من خمسة أزواج من النيوكليوتيدات وتحتوي على anticodon في وسط حلقةها. بواسطة هذا الحمض الريبي النووي النقال إلى موقع تخليق الببتيد.
بين الفروع المستقبلة و anticodon فرعين جانبيين. في حلقاتها ، تحتوي على قواعد معدلة - dihydrouridine (D-loop) وثلاثي TψC ، حيث \ y هو pseudouriain (T ^ C-loop). توجد حلقة إضافية بين فرعي أيتيكودون و T ^ C ، والتي تشمل من 3-5 إلى 13-21 نيوكليوتيدات. بشكل عام ، تتميز أنواع مختلفة من الحمض الريبي النووي النقال بثبات معين في تسلسل النيوكليوتيدات ، والذي يتكون غالبًا من 76 النيوكليوتيدات. يرجع الاختلاف في عددها بشكل أساسي إلى التغيير في عدد النيوكليوتيدات في الحلقة الإضافية. عادة ما يتم الحفاظ على المناطق التكميلية التي تدعم بنية الحمض النووي الريبي. يشكل الهيكل الأساسي للـ tRNA ، الذي يحدده تسلسل النيوكليوتيدات ، البنية الثانوية للـ tRNA ، والتي لها شكل ورقة البرسيم. في المقابل ، يتسبب الهيكل الثانوي في بنية ثلاثية الأبعاد تتميز بتكوين حلزونات مزدوجة متعامدة (الشكل 3.27). يتكون أحدهما من قبل المتقبل وفروع TψC ، والآخر بواسطة فرعي anticodon و D.
في نهاية أحد الحلزون المزدوج يوجد الحمض الأميني المنقول ، وفي نهاية الآخر يوجد anticodon. هذه المناطق هي الأبعد عن بعضها البعض. يتم الحفاظ على استقرار البنية الثلاثية للـ tRNA بسبب ظهور روابط هيدروجينية إضافية بين قواعد سلسلة polynucleotide ، الموجودة في أجزاء مختلفة منها ، ولكنها قريبة من الناحية المكانية في الهيكل الثالث.
أنواع مختلفة من الحمض الريبي النووي النقال لها نفس البنية الثلاثية ، على الرغم من وجود بعض الاختلافات.
^ I - البنية الثانوية للـ tRNA في شكل "ورقة البرسيم" ، يحددها هيكلها الأساسي (تسلسل النيوكليوتيدات في السلسلة) ؛
II - إسقاط ثنائي الأبعاد للهيكل الثلاثي للـ tRNA ؛
ثالثا - تخطيط جزيء الحمض الريبي النووي النقال في الفضاء
تتمثل إحدى ميزات الحمض النووي الريبي في وجود قواعد غير عادية فيه والتي تنشأ نتيجة التعديل الكيميائي بعد إدراج قاعدة عادية في سلسلة عديد النوكليوتيد. تحدد هذه القواعد المتغيرة التنوع الهيكلي الكبير للـ tRNAs في الخطة العامة لهيكلها. من الأهمية بمكان إجراء تعديلات على القواعد التي تشكل الكودون ، والتي تؤثر على خصوصية تفاعلها مع الكودون. على سبيل المثال ، الإينوزين الأساسي غير النمطي ، أحيانًا في الموضع الأول من الحمض الريبي النووي النقال المضاد ، قادر على الاندماج بشكل متكامل مع ثلاث قواعد ثالثة مختلفة لكودون الرنا المرسال - U ، C و A (الشكل 3.28). نظرًا لأن إحدى ميزات الشفرة الجينية هي انحلالها ، يتم تشفير العديد من الأحماض الأمينية بعدة أكواد ، والتي ، كقاعدة عامة ، تختلف في قاعدتها الثالثة. نظرًا للارتباط غير المحدد لقاعدة anticodon المعدلة ، يتعرف الحمض الريبي النووي النقال واحد على العديد من الكودونات المترادفة.
تم أيضًا إثبات وجود عدة أنواع من الحمض الريبي النووي النقال (tRNAs) القادرة على الارتباط بنفس الكودون. نتيجة لذلك ، ليس 61 (بعدد الكودونات) ، ولكن تم العثور على حوالي 40 جزيءًا مختلفًا من الحمض الريبي النووي النقال في سيتوبلازم الخلايا. هذه الكمية كافية لنقل 20 نوعًا من الأحماض الأمينية المختلفة إلى موقع تجميع البروتين.
جنبًا إلى جنب مع وظيفة التعرف الدقيق على كودون معين في الرنا المرسال ، فإن جزيء الحمض الريبي النووي النقال يسلم حمضًا أمينيًا محددًا بدقة مشفرًا بهذا الكودون إلى موقع تخليق سلسلة الببتيد. يستمر الارتباط النوعي للـ tRNA بـ "حمضه الأميني" على مرحلتين ويؤدي إلى تكوين مركب يسمى aminoacyl-tRNA. في المرحلة الأولى ، يتم تنشيط الحمض الأميني عن طريق التفاعل مع مجموعة الكربوكسيل مع ATP. نتيجة لذلك ، يتم تكوين حمض أميني أديبيل. في المرحلة الثانية ، يتفاعل هذا المركب مع مجموعة OH الموجودة في الطرف 3 بوصات من الحمض النووي الريبي المقابل ، ويربط الحمض الأميني مجموعة الكربوكسيل به ، ويطلق AMP. وهكذا ، تستمر هذه العملية مع إنفاق الطاقة التي تم الحصول عليها أثناء التحلل المائي لـ ATP إلى AMP يتم تحقيق خصوصية الجمع بين الحمض الأميني و tRNA الذي يحمل مضاد الكودون المقابل بسبب خصائص إنزيم aminoacyl-tRNA synthetase. في السيتوبلازم ، هناك مجموعة كاملة من هذه الإنزيمات التي هي قادر على -
التعرف المكاني ، من ناحية ، على الأحماض الأمينية ، ومن ناحية أخرى ، من الحمض الريبي النووي الريبي المقابل أولاً ، يضمن إنزيم إنزيم aminoacyl-tRNA synthetase اتصال الحمض النووي الريبي (tRNA) بالحمض الأميني الذي ينقله. ثم يتزاوج aminoacyl-tRNA بشكل مكمل مع mRNA من خلال تفاعل anticodon-codon. بمساعدة نظام الحمض الريبي النووي النقال (tRNA) ، لغة سلسلة نوكليوتيدات الرنا المرسال. تُرجمت إلى لغة تسلسل الأحماض الأمينية للببتيد RNA Ribosomal (rRNA). دورة الريبوسوم لتخليق البروتين. تتم عملية التفاعل بين mRNA و tRNA ، والتي تضمن ترجمة المعلومات من لغة النيوكليوتيدات إلى لغة الأحماض الأمينية ، على الريبوسومات. وهذه الأخيرة عبارة عن مجمعات معقدة من الرنا الريباسي وبروتينات مختلفة حيث تشكل الأولى إطارًا . RNAs الريبوزومية ليست فقط مكونًا هيكليًا للريبوسومات ، ولكنها تضمن أيضًا ارتباطها بتسلسل معين من نوكليوتيدات الرنا المرسال. هذا يحدد إطار البداية والقراءة لتشكيل سلسلة الببتيد. بالإضافة إلى ذلك ، فإنها توفر التفاعل بين الريبوسوم و tRNA. تؤدي العديد من البروتينات التي تتكون منها الريبوسومات ، جنبًا إلى جنب مع الرنا الريباسي ، الأدوار الهيكلية والإنزيمية ، وتتشابه ريبوسومات البروتينات وحقيقيات النوى في التركيب والوظيفة. تتكون من جزئين فرعيين: كبير وصغير. في حقيقيات النوى ، تتكون الوحدة الفرعية الصغيرة من جزيء واحد من الرنا الريباسي و 33 جزيء بروتين مختلف. تجمع الوحدة الفرعية الكبيرة بين ثلاثة جزيئات من الرنا الريباسي وحوالي 40 بروتينًا. تحتوي الريبوسومات بدائية النواة والريبوزومات الميتوكوندريا والبلاستيد على عدد أقل من المكونات. واحد منهم يحمل سلسلة عديد الببتيد المتنامية ، والآخر - mRNA. بالإضافة إلى ذلك ، يتم عزل اثنين من مواقع ربط الحمض النووي الريبي في الريبوسومات. يقع Aminoacyl-tRNA في aminoacyl ، موقع A ، ويحمل حمض أميني معين. في الببتيدل ، القسم P ، يوجد الحمض الريبي النووي النقال (tRNA) عادة ، والذي يتم تحميله بسلسلة من الأحماض الأمينية المتصلة بواسطة روابط الببتيد. يتم توفير تكوين موقعي A و P بواسطة كلتا الوحدتين الفرعيتين للريبوسوم.في كل لحظة ، يحمي الريبوسوم قطعة mRNA يبلغ طولها حوالي 30 نيوكليوتيد. هذا يضمن تفاعل اثنين فقط من الحمض الريبي النووي النقال (tRNAs) مع اثنين من أكواد الرنا المرسال المتجاورة ، ويتم التعبير عن ترجمة المعلومات إلى "لغة" الأحماض الأمينية في التراكم التدريجي لسلسلة الببتيد وفقًا للتعليمات الواردة في الرنا المرسال. تحدث هذه العملية على الريبوسومات ، والتي توفر التسلسل لفك تشفير المعلومات باستخدام الحمض الريبي النووي النقال. يمكن تمييز ثلاث مراحل أثناء الترجمة: بدء واستطالة وإنهاء تخليق سلسلة الببتيد.
^ تتكون مرحلة البدء ، أو بداية تخليق الببتيد ، من الجمع بين جسيمين فرعيين من الريبوسوم تم فصلهما سابقًا في السيتوبلازم في موقع معين من الرنا المرسال وربط أول aminoacyl-tRNA به. يحدد هذا أيضًا الإطار لقراءة المعلومات الموجودة في الرنا المرسال. في جزيء أي مرنا ، بالقرب من نهاية 5 بوصات ، يوجد موقع مكمل للـ rRNA للوحدة الفرعية الصغيرة للريبوسوم والذي يتعرف عليه تحديدًا. بعد ذلك إنه كودون البدء AUT ، الذي يشفر ميثيونين الأحماض الأمينية. تتصل الوحدة الفرعية الصغيرة للريبوسوم بـ mRNA بطريقة تجعل كود البدء OUT يقع في المنطقة المقابلة للموقع P. الوقت ، فقط الحمض الريبي النووي النقال البادئ الذي يحمل الميثيونين قادر على أخذ مكان في موقع P غير المكتمل للوحدة الفرعية الصغيرة والاتصال التكميلي بكودون البدء. أقسام الببتيدل والأمينواسيل
^ I - اتصال فرعي صغير من الريبوسوم مع mRNA ، والتعلق بكودون بدء الحمض الريبي النووي النقال الذي يحمل الميثيونين ، والذي يقع في موقع P غير المكتمل ؛ II - اتصال الجسيمات الفرعية الكبيرة والصغيرة من الريبوسوم بتكوين مواقع P و A ؛ ترتبط المرحلة التالية بالتنسيب في الموقع A من aminoacyl-tRNA المقابل لكودون mRNA الموجود فيه ، بداية الاستطالة ؛ ak - amino acid في نهاية مرحلة البدء ، يتم احتلال موقع P بواسطة aminoacyl-tRNA المرتبط بالميثيونين ، بينما في موقع A للريبوسوم ، يوجد الكودون التالي لكودون البدء. عند الانتهاء من مرحلة البدء وتشكيل الريبوسوم - mRNA - بدء مركب aminoacyl-tRNA ، يتم فصل هذه العوامل عن الريبوسوم. تشتمل مرحلة الاستطالة ، أو استطالة الببتيد ، على جميع التفاعلات من لحظة تكوين رابطة الببتيد الأولى إلى إضافة آخر حمض أميني. إنه حدث متكرر دوريًا حيث يوجد اعتراف محدد بالكودون التالي aminoacyl-tRNA الموجود في الموقع A ، وهو تفاعل تكميلي بين anticodon و codon.
نظرًا لخصائص التنظيم ثلاثي الأبعاد للـ tRNA. عندما يكون anticodon متصلاً بكودون mRNA. يقع الحمض الأميني المنقول بواسطته في الموقع A ، بالقرب من الأحماض الأمينية المدرجة سابقًا والموجودة في موقع P. تتكون رابطة الببتيد بين اثنين من الأحماض الأمينية ، يتم تحفيزهما بواسطة بروتينات خاصة تشكل الريبوسوم. نتيجة لذلك ، يفقد الحمض الأميني السابق ارتباطه بـ tRNA الخاص به وينضم إلى aminoacyl-tRNA الموجود في الموقع A. يتم تحرير الحمض الريبي النووي النقال الموجود في موقع P في هذه اللحظة ويذهب إلى السيتوبلازم.تترافق حركة الحمض النووي الريبي المحملة بسلسلة الببتيد من الموقع A إلى الموقع P مع تقدم الريبوسوم على طول mRNA بخطوة تقابل كودون واحد. الآن يتلامس الكودون التالي مع الموقع A ، حيث سيتم "التعرف عليه" على وجه التحديد بواسطة aminoacyl-tRNA المقابل ، والذي سيضع الحمض الأميني الخاص به هناك. يتكرر تسلسل الأحداث هذا حتى يتلقى الموقع A للريبوسوم كودون فاصل لا يوجد له الحمض الريبي النووي النقال المقابل ، ويتم تجميع سلسلة الببتيد بمعدل مرتفع بما فيه الكفاية ، اعتمادًا على درجة الحرارة. في البكتيريا عند 37 درجة مئوية ، يتم التعبير عنها على أنها إضافة 12 إلى 17 حمض أميني لكل ثانية واحدة إلى الببتيد الفرعي. في الخلايا حقيقية النواة ، يكون هذا المعدل أقل ويتم التعبير عنه بإضافة اثنين من الأحماض الأمينية في 1 ثانية.
^ ترتبط مرحلة الإنهاء ، أو إكمال تخليق عديد الببتيد ، بالتعرف على بروتين ريبوسومي محدد لأحد أكواد الإنهاء (UAA أو UAG أو UGA) عندما يدخل منطقة موقع A للريبوسوم. في هذه الحالة ، يتم توصيل الماء بآخر حمض أميني في سلسلة الببتيد ، ويتم فصل نهايته الكربوكسيلية عن الحمض الريبي النووي النقال. نتيجة لذلك ، تفقد سلسلة الببتيد المكتملة ارتباطها بالريبوسوم ، الذي ينقسم إلى جزئين فرعيين.
تباين الوراثة. 1-2 قانون مندل
يرجع استمرارية الوجود والتطور التاريخي للحياة البرية إلى خاصيتين أساسيتين للحياة: الوراثة والاختلاف.
على المستويات الخلوية والعضوية (الوراثية) لتنظيم الكائنات الحية ، تُفهم الوراثة على أنها خاصية للخلايا أو الكائنات الحية في عملية التكاثر الذاتي لنقل القدرة إلى جيل جديد على نوع معين من التمثيل الغذائي والتطور الفردي ، يتم خلالها تكوين سمات وخصائص مشتركة لنوع خلية معين ونوع من الكائنات الحية ، بالإضافة إلى بعض الخصائص الفردية للآباء. سيكون استمرار وجود الطبيعة الحية في الوقت المناسب على خلفية الظروف المتغيرة أمرًا مستحيلًا إذا لم يكن لدى الأنظمة الحية القدرة على اكتساب والحفاظ على تغييرات معينة مفيدة في الظروف البيئية الجديدة. تسمى خاصية الأنظمة الحية لاكتساب التغييرات والوجود في المتغيرات المختلفة التباين.
في الستينيات. القرن ال 19 مؤسس علم الوراثة (علم الوراثة والتنوع) جي مندل (1865) وضع الافتراضات الأولى حول تنظيم المواد الوراثية.بناءً على نتائج تجاربه على البازلاء ، توصل إلى استنتاج مفاده أن المادة الوراثية منفصلة ، أي تتمثل في الميول الوراثية الفردية المسؤولة عن تطور خصائص معينة للكائنات الحية. وفقًا لميندل ، في المادة الوراثية لكائنات التكاثر الجنسي ، يتم توفير تطوير سمة واحدة من خلال زوج من الميول الأليلية التي تأتي مع خلايا جرثومية من كلا الوالدين. أثناء تكوين الأمشاج ، يدخل واحد فقط من زوج من الميول الأليلية في كل منهما ، وبالتالي فإن الأمشاج تكون دائمًا "نقية". في عام 1909 ، أطلق في. جوهانسن على جينات مندل "الميول الوراثية".
مظهر من مظاهر الهجينة لخاصية واحد فقط من الوالدين مندل يسمى الهيمنة.
عند عبور الكائنات الحية التي تختلف في زوج واحد من الصفات المتناقضة ، والتي تكون أليلات جين واحد مسؤولة عنها ، يكون الجيل الأول من الهجينة موحدًا في النمط الظاهري والنمط الجيني. وفقًا للنمط الظاهري ، تتميز جميع الأنواع الهجينة من الجيل الأول بسمة سائدة ، وفقًا للنمط الجيني ، كل الجيل الأول من الهجينة متغاير الزيجوت