Epilepszia gyermekkorban
Jóindulatú részleges epilepszia esetén gyermekkor viszonyul:
- jóindulatú részleges epilepszia centrotemporális tüskékkel (rolandi epilepszia);
- jóindulatú részleges epilepszia occipitalis paroxizmákkal;
- jóindulatú részleges epilepszia affektív tünetekkel (jóindulatú pszichomotoros epilepszia). Szóba kerül az ebbe a további 2 formából álló csoportba való tartozás kérdése is:
- atipikus jóindulatú részleges epilepszia:
- jóindulatú parciális epilepszia extrém szomatoszenzoros kiváltott potenciálokkal.
Jóindulatú részleges epilepszia centrotemporális tüskékkel. (Rolandi epilepszia)
A betegséget először Gastaut írta le 1952-ben.
Frekvencia. A rolandi epilepszia viszonylag gyakori, és a 15 év alatti gyermekek összes epilepsziájának 15%-át teszi ki. Az előfordulási gyakoriság a hiányzásokhoz képest 4-7-szer magasabb. Elsősorban a hímek érintettek.
genetikai adatok. Az esetek 17-59%-ában nyomon követhető az epilepsziával kapcsolatos örökletes terhelés (Blom és mtsai, 1972; Blom, Heijbel, 1982).
Klinikai jellemzők. A rolandi epilepszia leggyakrabban 4-10 éves korban jelentkezik (Blom et al, 1972). A roham általában egyoldalú szenzoros érzésekkel (zsibbadás, bizsergés) kezdődik az orofacioman-dibularis régióban. A jövőben az arc izmainak tónusos feszültsége figyelhető meg, a végtagok klónus vagy tónusos-klónusos rángatózása kevésbé gyakori. Amikor a gége és a garat izmai részt vesznek a folyamatban, beszédzavarok figyelhetők meg (artikulálatlan hangok, a hangok kiejtésének teljes lehetetlensége). Görcsrohamok gyakran fordulnak elő ép tudat mellett, azonban a paroxizmusok általánossá válásával eszméletvesztés is lehetséges (Nayrac, Beaussart, 1958). A rolandi epilepszia egyik fontos jellemzője az éjszakai rohamok gyakori előfordulása, főként az elalvás fázisában, vagy röviddel az ébredés előtt. A rohamok általában ritkák. Általában hetes, hónapos időközönként fordulnak elő, néha egyszeriek. Csak az esetek 20%-ában viszonylag magas a rohamok gyakorisága (Lerman, 1985). Az intelligencia általában normális (Lerman, 1985; Dalla Bernardina és mtsai, 1992). Az intelligencia csökkenése, a viselkedés változása csak elszigetelt esetekben figyelhető meg (Beaumanoir et al, 1974; Lerman, 1985). A viselkedési zavarokat nem maga a betegség okozza, hanem másodlagosak, és a szülők „túlvédelméhez” kapcsolódnak (Lerman, 1985). Az abszolút távollét tézise a rolandi epilepsziában kóros elváltozások a központitól idegrendszer vitatható (Morikawa et al, 1979). Lerman (1985) felhívta a figyelmet arra, hogy a rolandiás epilepsziás esetek 3%-ában hemiparézis figyelhető meg. A Rolandic epilepsziás gyermekek iskolai teljesítménye általában kielégítő, a szakmai készségek pedig könnyen elérhetők.
Az EEG a diagnózis ellenőrzéséhez szükséges módszer. A rolandi epilepsziát a normál alapaktivitás és a centrotemporális régiókban lokalizált éles hullámok tüskéi jellemzik. Az alvás közbeni tüskék és éles hullámok gyakorisága nő. A lassú alvás fázisában lehetséges az epilepsziás aktivitás kétoldali vagy egymástól független gócainak kialakulása (Blom és mtsai, 1972; Dalla Bernardina és mtsai, 1992), és bizonyos esetekben a "tüskehullám" általános kitörései is előfordulhatnak. " komplexek egy frekvenciával
3-4/sec (Lerman, 1985, 1992). Meg kell jegyezni, hogy az esetek 30%-ában a Rolandi-epilepsziára jellemző EEG-mintázatokat csak alvás közben rögzítik (Lerman, 1985). A rolandi epilepszia alvásprofilja azonban általában változatlan (Nayrac és Beaussart, 1958). Felhívjuk a figyelmet arra, hogy időnként (az esetek 1,2-2,4%-ában) "rolandi tüskék" figyelhetők meg. egészséges emberek(Cavazutti és mtsai, 1980) és bizonyos betegeknél neurológiai betegségek(Degen és munkatársai, 1988).
Megkülönböztető diagnózis elsősorban szimptomatikus parciális epilepsziákban észlelt egyszerű és összetett fokális rohamokkal kell elvégezni. Rolandiás epilepsziában a tünetekkel járó részleges epilepsziával összehasonlítva az intelligencia általában normális, nincsenek kifejezett viselkedési zavarok, és nem észleltek kóros elváltozást a neuroradiológiai vizsgálatokban. A tipikus mintázatokat az EEG rögzíti - normál alapaktivitás és a centrotemporális lokalizáció tüskéi.
A rolandi epilepszia és a komplex részleges paroxizmák legnehezebb differenciáldiagnózisa, tudatzavarral kombinálva (Lerman, 1985). A differenciáldiagnózis nehézségei a rolandi epilepszia beszédzavarainak tudatzavarként való téves értelmezésével, valamint a tudatzavar megfelelő értékelésének lehetetlenségével járnak. éjszaka előforduló. Temporális és frontális epilepszia esetén az EEG fokális elváltozásokat tár fel a megfelelő területeken, rolandiás epilepszia esetén pedig centrotemporális lokalizációjú tüskék észlelhetők.
Kezelés. A Sultiam kielégítő hatást fejt ki a Rolandic epilepszia kezelésében (Doose és mtsai, 1988) A gyógyszer dózisát a betegség klinikai megnyilvánulásai határozzák meg. Megjegyzendő, hogy „az epilepsziás fókusz elnyomása az EEG-n nem kötelező, mivel pubertáskorban magától eltűnik.
Atípusos jóindulatú gyermekkori epilepszia
Első alkalommal a nosológiai függetlenség feltételezése atipikus jóindulatú epilepszia gyermekkorát Aicardi, Chevru fejezte ki 1982-ben. 7 beteg vizsgálata alapján. Az epilepszia ezen formájának nozológiai függetlenségének kérdése azonban a mi szempontunkból a kis számú megfigyelés miatt további tisztázást igényel.
Klinikai jellemzők. A betegség korai gyermekkorban nyilvánul meg. Figyelemre méltó, hogy Aicardi, Chevru (1982) által megfigyelt 7 betegből 3-ban a betegség éjszakai generalizált és egyoldalú? görcsrohamok, ritka részleges paroxizmákkal kombinálva. Nappali hiányzásokat, atóniás és myoclonus paroxizmusokat is megfigyeltek. A támadások gyakran gyakoriak, sorozatos formában, 30 rohamban haladnak; egy napon belül. A rohamok változatossága és nagy gyakorisága ellenére azonban a neuropszichés fejlődés megfelel az életkornak. 9 éves korban a rohamok spontán eltűnnek.
Laboratóriumi és funkcionális vizsgálatokból származó adatok. A nem REM alvás során végzett EEG-vizsgálat elhúzódó vagy csaknem állandó tüskehullám komplexeket, valamint a centrotemporális vagy parietális régiókban lokalizált rolandi tüskéket tár fel. Ezen túlmenően ébredéskor 3/mp gyakorisággal rögzítik a szabálytalan tüske-hullám komplexeket. vagy általánosított lassú tüskehullám komplexek.
Megkülönböztető diagnózis számos prognosztikailag súlyos gyermekkori epilepsziás szindrómával – Lennox-Gastaut szindrómával, myoklonus-asztatikus epilepsziával, valamint ESES-szindrómával – kell elvégezni. A leggyakoribb diagnosztikai hiba, hogy az atípusos jóindulatú epilepsziát Lennox-Gastaut-szindrómának tekintik. A differenciáldiagnózis elvégzésekor figyelembe kell venni, hogy a Lennox-Gastaut-szindróma a neuropszichés fejlődés kifejezett késleltetésével párosul. A Lennox-Gastaut-szindrómára jellemző éjszakai tónusos rohamok jellegzetes EEG-mintázattal, általánosított lassú tüskehullám komplexek formájában, 2-2,5/s gyakorisággal. Kivételt képez ezeknek a komplexeknek a gyakoriságának növekedése alvás közben Lennox-Gastaut szindrómában.
A myoklonus-asztatikus epilepsziát az atipikus jóindulatú részleges epilepsziával összehasonlítva az intelligencia csökkenése jellemzi, nincsenek részleges paroxizmusok, valamint lassú tüske-hullám komplexek alvás közben.
Az atipikus jóindulatú parciális epilepszia és az ESES-szindróma differenciáldiagnózisa egy poliszomnográfiás vizsgálat eredményein alapul, amely tipikus mintákat tár fel,
Kezelés. A rohamok általában spontán eltűnnek. Mivel atípusos jóindulatú részleges epilepsziában nem csökken az intelligencia, a kombinált görcsoldó terápia nem javasolt.
Gyermekkori jóindulatú részleges epilepszia occipitalis paroxizmákkal
A gyermekkori jóindulatú részleges epilepsziát occipitalis paroxizmákkal először Gastaut írta le 1950-ben.
genetikai adatok. A genetikai tényezők szerepe a betegség kialakulásában tagadhatatlan. Sok beteg családjában előfordult epilepszia és migrén (Kuzniecky, Rosenblatt, 1987).
Klinikai jellemzők. A betegség főleg 2-8 éves korban jelentkezik. Ugyanakkor leírják a betegség korábbi megjelenését is. Gastaut (1992) megjegyezte, hogy a betegség 5-17 éves korban jelentkezhet. A rohamok legjellemzőbb megnyilvánulásai az epilepszia ezen formájában a látászavarok - egyszerű és összetett vizuális hallucinációk, illúziók, amaurosis (Gastaut, 1992). Ezek a tünetek elszigeteltek vagy görcsös paroxizmákkal és átmeneti hemiparesissel kombinálhatók. Gyakran a rohamok során figyelhetők meg fejfájás, hányás, a fej és a szem elfordulása, egyes esetekben dysesthesia, dysphagia (Kivity, Lerman, 1992). Hosszan tartó tudatzavarral járó rohamokat írtak le - 12 órán belül (Kivity, Lerman, 1992). Panayiotopoulos (1989) megjegyezte, hogy a támadások leggyakrabban éjszaka fordulnak elő, és különböző mértékű tudatzavarral, hányással, eltéréssel kísérik. szemgolyók.
Laboratóriumi és funkcionális vizsgálatokból származó adatok. Az EEG-vizsgálat normál alapaktivitást, nagy amplitúdójú (200-300 mV) egy- vagy kétoldali éles hullámokat vagy tüske-hullám komplexeket regisztrál az occipitalis régiókban. Ezek a változások eltűnnek, amikor kinyitják a szemet. A hiperventiláció és a fotostimuláció nem befolyásolja az epilepsziás EEG-minták gyakoriságát és jellegét. Az esetek 38%-ában az EEG-vizsgálat általánosított, kétoldalúan szinkron "tüske-hullám" vagy "többspike-hullám" komplexeket is feltár.
Megkülönböztető diagnózis egyszerű és összetett részleges paroxizmákkal, Lennox-Gastaut szindrómával, basilaris migrénnel kell elvégezni. Az occipitalis lebeny szerkezeti károsodása miatti tünetekkel járó részleges epilepsziák az anamnézis, a neurológiai állapot és a neuroradiológiai vizsgálat alapján kizártak, amelyek általában kóros elváltozásokat tárnak fel. A szimptómás occipitalis epilepsziákban a jóindulatú occipitalis epilepsziákhoz képest a szemnyitás nem blokkolja az epilepsziás aktivitást az EEG-n.
A Lennox-Gastaut-szindróma differenciáldiagnózisa a szindrómára jellemző tónusos rohamok és EEG-minták meglétén alapul. Basilaris migrén esetén az EEG-n nincs epilepsziás aktivitás. Kezelés. Az első számú gyógyszer a karbamazepin.
Jóindulatú részleges epilepszia affektív tünetekkel. (jóindulatú pszichomotoros epilepszia)
Klinikai jellemzők. A betegség 2-9 éves korban jelentkezik. A vezető tünetek a félelem rohamai. Ezek a paroxizmusok nappal és éjszaka egyaránt előfordulnak. Nem volt különbség a nappali és éjszakai paroxizmusok klinikai megnyilvánulásai között. A jóindulatú pszichomotoros epilepszia rohamainak legjellemzőbb jelei a félelem rohamai: a beteg hirtelen megijed, anyjához tud kapaszkodni, néha nyelési, rágási automatizmusok jelentkeznek. Nevetés, nyögés, vegetatív-zsigeri rendellenességek (hiperhidrosis, nyálfolyás, hasi fájdalom) is megfigyelhetők, egyes esetekben - a beszéd megállítása (Dalla Bernardina et al, 1992). Hangsúlyozni kell, hogy az epilepszia ezen formájával tónusos, tónusos-klónusos, atonikus rohamok nem figyelhetők meg.
Laboratóriumi és funkcionális vizsgálatokból származó adatok. Az EEG-vizsgálat normál alaptevékenységet, ritmikus tüskéket vagy "akut-lassú hullámú" komplexeket regisztrál, amelyek túlnyomórészt a frontotemporális vagy parietotemporális régiókban lokalizálódnak (Dalla Bernardina és mtsai, 1992). Az epilepsziás mintázatok gyakorisága nő a nem REM alvás során.
Megkülönböztető diagnózis komplex részleges rohamokkal, Rolandi epilepsziával, rémálmokkal kell elvégezni.
A jóindulatú parciális epilepszia, affektív tünetekkel és komplex részleges paroxizmákkal járó differenciáldiagnózisa a betegségre jellemző kritériumokon alapul: korai gyermekkori megjelenés, normális intelligencia, neurológiai állapot változása és neuroradiológiai vizsgálat. Egyes esetekben a rolandiás epilepszia differenciáldiagnózisa meglehetősen nehéz. Mint ismeretes, a rolandi epilepsziát gyakran beszédzavar, torokhangok, nyálfolyás kíséri. Néha hasonló tünetegyüttes figyelhető meg affektív tünetekkel járó jóindulatú részleges epilepsziában. Az affektív tünetekkel járó jóindulatú részleges epilepszia javára kifejezett pszichomotoros tünetek bizonyulnak, amelyek ebben a betegségben mindig jelen vannak.
Az éjszakai rettegés klinikai megnyilvánulásaiban nagyon hasonló a jóindulatú pszichomotoros epilepsziában megfigyelt görcsrohamokhoz. A jóindulatú pszichomotoros epilepsziához képest a rémálmok kizárólag éjszaka fordulnak elő, gyakori rohamok és az epilepsziás minták hiánya az EEG-n.
Kezelés. A karbamazepin és a fenitoin kielégítő hatást fejt ki a jóindulatú pszichomotoros epilepszia kezelésében. A betegség prognózisa kedvező.
Jóindulatú parciális epilepszia extrém (óriás) szomatoszenzoros kiváltott potenciálokkal
Dawson 1947-ben elsőként mutatta ki, hogy nagy amplitúdójú (400 mV-ig) kiváltott potenciálok jelentkeznek egyes betegekben, akiknek részleges paroxizmusa van és a szomatoszenzoros régiók károsodása szomatoszenzoros stimuláció során jelentkezik. Ezeket a potenciálokat a stimulációval ellentétes oldalon rögzítjük. A legnagyobb potenciál amplitúdó a parasagittalis és parietális régiókban figyelhető meg. De Marco 1971-ben publikálta egy egyedülálló megfigyelés eredményeit, ahol a láb külső szélének érintése epilepsziás mintázatot okozott az EEG-n. Később De Marco, Tassinari (1981) nagy tanulmányt végzett, 25 000 elektroencefalogramot elemezve 1500 gyermeken. Azt találták, hogy a gyermekek 1%-ánál a sarkok, ujjbegyek, vállak, karok vagy combok szenzoros stimulációja óriási szomatoszenzoros kiváltott potenciálokat vált ki. Figyelemre méltó, hogy a vizsgált gyermekek 30%-a szenvedett epilepsziás rohamban, 15%-uk élete későbbi szakaszában jelentkezett.
Klinikai jellemzők. Az óriás szomatoszenzoros kiváltott potenciálok 4-6 éves korban jelentkeznek, gyakrabban fiúknál. A betegek kórtörténetében gyakran szerepelnek lázgörcsök. A legtöbb esetben a támadások napközben jelentkeznek. Leggyakrabban a paroxizmusok motoros tünetekben nyilvánulnak meg, amelyek verzív komponenst tartalmaznak, de előfordulhatnak generalizált tónusos-klónusos rohamok is, korábbi fokális rendellenességek nélkül. Az epilepsziás szomatoszenzoros potenciálok az epilepsziás roham után is fennmaradnak. A támadások viszonylag ritkák, évente 2-6 alkalommal. Az értelem nem szenved.
Laboratóriumi és funkcionális vizsgálatokból származó adatok. 2,5-3,5 éves korban óriási szomatoszenzoros kiváltott potenciálok keletkeznek, később az EEG-n spontán kialakuló fokális epilepsziás mintázatok rögzíthetők, először csak alvásban, majd ébrenlétben figyelhetők meg. Egy évvel az epilepsziás minták EEG-n való megjelenése után klinikailag kifejezett epilepsziás rohamok is előfordulnak.
megkülönböztető diagnózis. A legnehezebb differenciáldiagnózis rolandiás epilepsziával. A "jóindulatú parciális epilepszia óriási szomatoszenzoros kiváltott potenciállal" diagnózisát alátámasztó kritériumok a következők: ép arcizmok a roham idején, az EEG-minták parasagittalis és parietális lokalizációja, az epilepsziás szomatoszenzoros kiváltott potenciálok spontán eltűnése.
Kezelés. Az antikonvulzív terápia hatástalan. Az epilepsziás rohamok általában spontán eltűnnek
Landau Kleffner szindróma
A szindrómát először Landau, Kleffner 1957 írta le. Eddig körülbelül 200 betegséget írtak le (Deonna, 1991).
genetikai adatok. Beaumanoir (1992) szerint gyakran megfigyelhető az örökletes epilepszia.
Klinikai jellemzők. A betegség 3-7 éves korban jelentkezik (Deonna, 1991). Jellemző az afázia, az epilepsziás rohamok és a viselkedési zavarok tüneteinek hármasa. A korai tünetek a progresszív beszédkárosodás és a verbális agnosia (Pauquier és mtsai, 1992). A beszédzavarokra jellemző a beszédperseverációk, parafázia, zsargon-afázia megjelenése. A legtöbb esetben nincs előzetes beszédkárosodás (Echnne, 1990; Deonna, 1991). Az afáziás rendellenességek ingadozó lefolyásúak lehetnek, rövid távú remissziókkal (Deonna és mtsai, 1989). 2/3-3/4 esetben epilepsziás rohamok alakulnak ki. A rohamok általában egyszerű részleges motoros rohamok. Kevésbé gyakoriak a generalizált tónusos-klónusos, hemiklónusos vagy komplex részleges rohamok és hiányok. Az atóniás és tónusos paroxizmusok rendkívül ritkák. A betegek 1/3-ánál ritkák az epilepsziás rohamok. Status epilepticus ritkán alakul ki. Az epilepsziás rohamok egyik jellemzője Landau-Kleffner szindrómában az éjszakai jelleg. A támadások általában rövidek. A viselkedési zavarok agresszivitás, hiperaktivitás, autizmus formájában nyilvánulnak meg.
Laboratóriumi és funkcionális vizsgálatokból származó adatok. Az EEG-vizsgálat normál alaptevékenységet, fokális vagy multifokális tüskéket, éles hullámokat, tüske-hullám komplexeket regisztrál, amelyek túlnyomórészt a temporális, parietális-temporális vagy parietális-occipitalis régiókban lokalizálódnak. Egyes esetekben Landau-Kleffner-szindrómában rolandi tüskék találhatók az EEG-n. A Landau-Kleffner-szindróma tipikus EEG-mintázata az elektromos állapot epilepticus nem REM alvás közben (ESES) (Rodriguez, Niedermeyer, 1982).
A neuroradiológiai vizsgálat kóros elváltozást nem mutatott ki. A spektrális pozitronemissziós tomográfia csökkent perfúziót mutat a bal középső frontális gyrus és a jobb mediotemporális régióban (Mouridson és mtsai, 1993). A pozitronemissziós tomográfia metabolikus rendellenességeket tár fel a temporális régióban (Maquet és mtsai, 1990), amelyek a klinikai javulás után is fennmaradnak. A differenciáldiagnózist mindenekelőtt az afáziával járó betegségek - daganatok, fertőzések, anyagcserezavarok - esetén kell elvégezni.
Kezelés. A beszédzavarok görcsoldó terápiája gyakorlatilag hatástalan (Marescaux és mtsai, 1990). Az ACTH jótékony hatású, azonban hosszú távú alkalmazása lehetetlen. jelentős figyelem komplex terápia logopédiai órákra kell adni a beszédzavarok korrigálása érdekében.
Epilepsziás szindrómák gyermekeknél: diagnózis és kezelés
Mukhin Konsztantyin Jurijevics
Petrukhin Andrej Szergejevics
Epilepszia- a gyermekneurológia egyik legsürgetőbb problémája. Az epilepszia gyakorisága a gyermekpopulációban a gyermekpopuláció 0,5-0,75% -a, a lázas rohamok pedig legfeljebb 5%. Sajnálattal kell megállapítani, hogy hazánkban még mindig nagy a zűrzavar az epilepszia diagnózisának felállításában, ami jelentősen torzítja a statisztikákat. Az olyan diagnózisok, mint az „epileptiform szindróma”, „görcsös szindróma”, „fokozott görcsös készenlét” stb., valójában epilepsziák, és egyértelműen rendszerezni kell a Nemzetközi Osztályozás szerint. A kiadvány célja, hogy az orvosokat megismertesse a gyermekeknél előforduló epilepszia fő formáinak osztályozásával, diagnosztikájának és kezelésének elveivel.
Meghatározás. Az epilepszia egy krónikus agyi betegség, amelyet a túlzott mértékű idegi kisülések következtében fellépő motoros, szenzoros, autonóm, mentális vagy mentális funkciók visszatérő, provokálatlan rohamai jellemeznek. A bemutatott meghatározás két fontos rendelkezést tartalmaz. Először is, az epilepszia nem foglalja magában az egyszeri rohamokat, függetlenül azok klinikai megnyilvánulásaitól. Csak az ismétlődő rohamok képezik az alapját az epilepszia diagnózisának. Másodszor, az epilepszia magában foglalja a spontán, provokálatlan rohamokat (a reflexformák kivételével). Értelemszerűen lázas rohamok, valamint akut agyi rendellenességek (pl. encephalitis, subduralis hematoma, akut) görcsrohamok agyi keringés stb.) nem epilepsziás.
Osztályozás. Az epilepszia megnyilvánulásai rendkívül változatosak, ami megnehezítette az egységes osztályozás létrehozását a betegség vizsgálatának kezdetétől fogva. Az epilepsziás rohamok modern osztályozását a Nemzetközi Epilepszia Liga 1981-ben fogadta el Kiotóban (Japán). A korábbi besorolásoktól eltérően a legtöbb epilepsziás rohamtípus klinikai és neurofiziológiai (EEG) kritériumait egyaránt figyelembe veszi (1. táblázat). A besorolás az epilepsziás rohamok minden típusát részleges (fokális, fokális, lokális, lokalizációfüggő), generalizált és nem osztályozott epilepsziás rohamokra osztja fel. Részleges rohamokat akkor diagnosztizálnak, ha egyértelmű klinikai és elektrofiziológiai kritériumok vannak bizonyos agyi struktúrák érintettségére a paroxizmus kezdetén. Abban az esetben, ha a roham részlegesen kezdődik, majd a törzs és a végtagok teljes izmai érintettek, és mindkét félteke érintettségének jelei vannak az EEG-n, akkor másodlagos generalizációval gócosnak kell minősíteni.
Az osztályozás tisztázta az egyszerű és összetett részleges rohamok fogalmát. Egyszerű részleges - rohamok a tudat kikapcsolása nélkül. Az összetett részleges rohamok teljességgel járó rohamokként értendők a tudat kikapcsolása. A modern besorolás szerint minden olyan roham, amely deperszonalizációs jelenségekkel, álomállapotokkal, kognitív zavarokkal stb. fordul elő, nem összetett, hanem egyszerűen részleges, mivel a beteg tudata ezen rohamok során megváltozik, de nem kapcsol ki, és a beteg emlékezete a rohamok megmaradnak. Az 1981-es osztályozás azt is előírja, hogy egy betegnek több is lehet
különböző típusú rohamok. Például egy egyszerű részleges támadás átalakulhat összetett részlegessé, majd másodlagos általánosítotttá. A „polimorf rohamok” kifejezést eltávolították az osztályozásból, amely nem tartalmaz információt, és használata nem javasolt. Így a kiotói besorolás ebben a szakaszban az epilepsziás rohamok legteljesebb rendszerezése.
A klinikai tapasztalatok felhalmozásával, a video-EEG monitorozási módszer gyakorlati bevezetésével, a neuroimaging módszerek, a molekuláris genetika és más tudományok fejlődésével nyilvánvalóvá vált, hogy az epilepsziának számos olyan speciális formája létezik, amelyekre jellemző a saját klinika (a rohamok tipikus típusai), lefolyása és prognózisa . Néhány ilyen forma régóta ismert, mint például a West-szindróma, a Lennox-Gastaut-szindróma, a Rolandi-epilepszia. Másokat - jóindulatú családi újszülöttkori görcsöket, súlyos csecsemőkori myoklonus epilepsziát stb. - csak az elmúlt években azonosítottak. Az epilepszia ezen formái, ill Nemzetközi osztályozás, az epilepsziás szindrómák általában nem egyfajta rohamban, hanem azok kombinációjában nyilvánulnak meg. Az epilepsziás szindrómákat az epilepszia különálló, független formáiként definiálják, amelyeket a rohamok megjelenésének korlátozott kora, a rohamok speciális típusának jelenléte, az EEG specifikus változásai (ez a szindróma jellemző), a lefolyás és a prognózis jellemez. Például számos epilepsziás szindróma struktúrájába beépíthető a rohamok egy típusa – az abszansok –: gyermekkori és fiatalkori abszolválási epilepszia, juvenilis myoclonus epilepszia, myoclonus hiányokkal járó epilepszia és mások, valamint mindezen szindrómák lefolyása és prognózisa. különbözők.
Az epileptológia fejlődésében alapvetően új lépés volt az "epilepszia, epilepsziás szindrómák és rohamokkal járó betegségek" modern osztályozásának megalkotása. Ezt a besorolást a Nemzetközi Epilepszia Elleni Liga 1989 októberében, Újdelhiben fogadta el, és jelenleg az epileptológusok világszerte általánosan elfogadják (2. táblázat).
Az epilepsziás szindrómák osztályozása a következő elveken alapul:
Lokalizációs elv:
az epilepszia lokalizációfüggő (fokális, lokális, részleges) formái;
általánosított formák;
részleges és általánosított jellemzőkkel rendelkező formák.
Az etiológia elve:
szimptomatikus,
kriptogén,
idiopátiás.
A rohamok kezdeti kora:
újszülött formák,
csecsemő,
baba,
fiatalos.
A rohamok fő típusai, amelyek meghatározzák a szindróma klinikai képét:
hiányzások,
myoklonus hiányok,
infantilis görcsök stb.
A tanfolyam jellemzői és az előrejelzés:
jóindulatú;
súlyos (rosszindulatú).
Az osztályozás az epilepszia minden formáját tüneti, idiopátiás és kriptogén epilepsziára osztja. Tüneti formák az ismert etiológiájú és igazolt morfológiai rendellenességekkel (tumorok, hegek, gliózis, ciszták, dysgenesis stb.) járó epilepsziás szindrómák. Az idiopátiás formákban nincsenek olyan betegségek, amelyek epilepsziát okozhatnak, az epilepszia pedig mintegy önálló betegség. Jelenleg az epilepszia idiopátiás formáinak genetikai determinizmusát megállapították. A "kriptogén" (rejtett) kifejezés azokra a szindrómákra vonatkozik, amelyek oka rejtett, tisztázatlan marad. Ezek a szindrómák nem felelnek meg az idiopátiás formák kritériumainak, de nincs bizonyíték tüneti jellegükre. Például az epilepszia hemiparesissel vagy oligofréniával való kombinációja esetén feltételezik a betegség tüneti jellegét, de a CT és MRI vizsgálatok nem vizualizálják az agyban bekövetkező változásokat. Ez az eset kriptogénnek minősül. Nyilvánvalóan a neuroimaging technikai lehetőségeinek (például PET) javulásával a legtöbb kriptogén forma átkerül a tüneti formák kategóriájába.
Tünetek. A különféle epilepsziás rohamok szemiológiáját és klinikáját számos epilepsziás kézikönyv részletesen leírja. Az epilepszia bizonyos formáinak (epilepsziás szindrómák) diagnózisa azonban kevés figyelmet kapott a szakirodalomban. Maradjunk a gyermek- és serdülőkori fő epilepsziás szindrómák diagnózisának kritériumainál és a terápia alapelvein.
Infantilis hiányepilepszia
Hiányzások- a generalizált nem görcsös rohamok egy fajtája, amelyet nagy gyakorisággal és rövid időtartamú eszméletvesztéssel járó paroxizmusok és egy specifikus mintázat jelenléte az EEG-n - generalizált csúcshullám-aktivitás 3 Hz-es frekvenciával.
A hiányzások debütálása gyermekkori hiányepilepsziában (DAE) a 2 és 9 év közötti életkorban figyelhető meg, átlagosan 5,3 év. A megnyilvánulás életkori csúcsa 4-6 év, a nemek szerint a lányok túlsúlya.
Klinikailag a távollétekre a tudat hirtelen rövid távú leállása (vagy a szint jelentős csökkenése) jellemző, hiányzó vagy minimális motoros jelenségekkel. Az aura, mint a támadás utáni zavarodottság, nem jellemző. A hiányzások időtartama 2-3 másodperctől 30 másodpercig terjed, átlagosan 5-15 másodperc. A távolléti rohamok jellemző jellemzője a rohamok nagy gyakorisága, amely naponta több tíz és száz rohamot is elér.
A legfontosabb dolog a hiányzások egyszerű és összetett felosztása. Az egyszerű hiányzásokat minden tevékenység abbahagyása, a betegek "lefagyása", "elfakulása", rögzített "hiányzó" tekintet, zavart, hipomimikus arckifejezés jellemzi. Egyszerű hiányzások klinikai kép A DAE csak 20%-ot tesz ki. A DAE esetében jellemzőbbek az összetett hiányzások, amelyek minimális motoros komponens mellett fordulnak elő. A következő típusú komplex hiányok léteznek: myoklonus, tónusos, atonikus, vegetatív komponenssel, valamint automatizmusokkal és fokális jelenségekkel. Leggyakrabban myoklonus és tónusos komponensek hiányát állapítják meg.
A DAE-ben szenvedő betegek 40%-ánál észleltek myoklonus komponens hiányát. Megnyilvánult: szemhéj myoclonus; periorális myoclonus (az ajkak ritmikus nyújtása, mint egy "aranyhal"); perinazális myoclonus (az orr szárnyainak ritmikus rángatózása). Számos betegnél a támadás során a vállöv és/vagy a kar izmainak egyszeri borzongását vagy több rövid gyenge rándulást észlelnek.
A DAE-re a legjellemzőbb a tónusos komponens hiánya, amely a betegek 50%-ánál fordul elő. Megnyilvánul a fej, néha a test, a hát (retro-pulzív hiányok) eltérésében, a szemgolyók tónusos elrablásával felfelé vagy oldalra. A támadás során néha enyhe tónusos feszültség (általában aszimmetrikus) jelentkezik a felső végtagok izmában.
Az atóniás komponens hiánya nem jellemző a DAE-re, és csak elszigetelt esetekben, főleg atipikus formákban figyelhető meg. Megnyilvánul a kar izomzatának (tárgyakból való kiesés), a nyak (passzív bólogatás), a lábak izomzatának hirtelen elvesztésével (atóniás-asztatikus rohamok). Az atóniás hiányokat a Lennox-Gastaut szindrómában gyakrabban nevezik atipikus hiánynak (a csúcshullám komplexek gyakorisága kisebb, mint 2,5 Hz).
A vegetatív komponens hiányát átlagosan a DAE-ben szenvedő betegek 5%-ánál figyelték meg. A roham idején vizelet-inkontinencia, mydriasis, az arc és a nyak bőrének elszíneződése, csalánkiütés megjelenésével nyilvánul meg ezeken a területeken.
A fokális komponenssel járó hiányokat a betegek 15% -ánál észlelik, és jelentősen túlsúlyban vannak a tónusos hiányban szenvedő betegeknél. Roham során a kar vagy az arc izmai enyhe egyoldalú feszültséget tapasztalnak, néha egyszeri myoklonus rándulással; a fejet és a szemeket oldalra fordítva. Emlékeztetni kell arra, hogy a kifejezett fokális jelenségek megjelenése a támadások során riasztó a betegek részleges paroxizmusának jelenléte tekintetében. A hiányzások szerkezetének automatizmusait a DAE-ben szenvedő betegek 35% -ánál figyelték meg. A gesztusok leggyakoribb automatizmusai a garat-orális és a beszéd.
A hiányzások állapotát a DAE-ben körülbelül 10%-os gyakorisággal állapítják meg. Ez az állapot a hiányzások meredek növekedésében nyilvánul meg, közvetlenül vagy nagyon rövid időközönként egymás után. Amimia, nyálfolyás, motoros retardáció (stupor) figyelhető meg. Az állapot időtartama több órától több napig terjedhet.
Generalizált görcsrohamokat (GSP) a DAE-ben szenvedő betegek 1/3-ában diagnosztizálnak. A távolléti rohamok kezdetétől a GSP-hez való csatlakozásig több hónap vagy év telik el. A legtöbb esetben a HSP 1-3 évvel a betegség kezdete után csatlakozik (65% a HSP-ben szenvedő betegek csoportjában), ritkábban - 4-13 év között (35%). Ritka generalizált tónusos-klónusos görcsös paroxizmusok dominálnak.
A gyakoribb hiányzást kiváltó tényezők a következők: hiperventiláció; alvásmegvonás; fotostimuláció; intenzív mentális tevékenység, vagy fordítva, ellazult, passzív állapot. A hiperventiláció a fő provokáló tényező a hiányzások előfordulásában. A kezeletlen DAE-ben szenvedő betegek 3 perces hiperventilációja az esetek közel 100%-ában hiányzást okoz; az AED-ben részesülő betegeknél pedig a gyógyszeres terápia hatékonyságának egyik kritériumaként szolgál.
A DAE interiktális periódusában észlelt epileptiform aktivitás gyakorisága magas, és 75-85%. A legjellemzőbb EEG-mintázat az általánosított csúcshullám-aktivitás kitörései. A csúcshullám komplexek gyakorisága másodpercenként 2,5 és 4-5 között változik. (általában 3 Hz - jellemző hiányzások).
Kezelés. A DAE-ben a teljes terápiás remisszió az esetek 70-80%-ában érhető el, a többi betegeknél pedig a rohamok számának jelentős csökkenése. A kezelést mindig valproinsav-készítményekkel kell kezdeni. Az átlagos adagok 30-50 mg / kg / nap. 3 adagban. Szintén látható magas hatásfok szuximid a távolléti rohamok enyhítésére. A gyógyszer átlagos adagja 15 mg / kg / nap. 2-3 adagban. A szuximid terápia jelentős negatív pontja a gyógyszer GSP-re gyakorolt hatásának teljes hiánya. A valproát és szukcinimid monoterápiával szembeni hiányok rezisztenciája miatt valproát és szuximid, vagy valproát és lamotrigin (Lamiktal) kombinációját írják elő. A Lamictal átlagos napi adagja valproáttal kombinálva 1-5 mg/ttkg/nap. 2 adagban. A karbamazepin (finlepsin, tegretol, timonil) alkalmazása kategorikusan ellenjavallt az epilepszia minden formája esetén a gyakoribb görcsrohamok nagy valószínűsége miatt.
Fiatalkori hiány epilepszia
A juvenilis hiányepilepszia (JAE) az idiopátiás generalizált epilepszia egyik típusa, amelyet a rohamok fő típusa jellemez - a pubertás időszakában debütáló abszankciós rohamok, amelyek nagy valószínűséggel GSP-tapadás és jellegzetes EEG-változások generalizált csúcshullám-aktivitás formájában. 3 Hz vagy annál nagyobb frekvenciával.
A JAE-ben a hiányzások debütálása 9 és 21 év között változik, átlagosan 12,5 év. A betegek jelentős többségénél (75%) a hiányzások viszonylag rövid időn belül – 9-13 éven belül – kezdődnek. A SIA fontos jellemzője a betegség gyakori kialakulása HSP-vel - az esetek 40% -ában.
A JAE-ben szenvedő betegek hiánya rövid eszméletvesztésben nyilvánul meg fagyással és hipomimiával. Jellemző az egyszerű hiányzások, vagyis a motoros komponens nélküli rohamok túlsúlya. A támadások időtartama 2-30 másodperc, átlagosan 5-7 másodperc. Ugyanakkor a betegek felének nagyon rövid, legfeljebb 3 másodperces távollétei vannak. A JAE jellegzetessége a rohamok viszonylag alacsony gyakorisága a DAE-hez képest. A legtöbb betegnél az egyszeri hiányzások dominálnak a nap folyamán, vagy 1 roham 2-3 napon belül.
Generalizált görcsös rohamok figyelhetők meg a betegek többségében - 75%. A GSP-ben szenvedő betegek csoportjában a betegség gyakran nem hiányzásokkal, hanem tónusos-klónusos görcsös paroxizmusokkal debütál. A GSP-ket rövid, ritka tónusos-klónusos rohamok jellemzik, amelyek általában felébredés vagy elalvás után jelentkeznek.
A DAE-vel ellentétben a hiperventiláció a JAE-ben szenvedő betegek legfeljebb 10%-ában okoz abszansz rohamokat. A betegek 20%-ában a GSP-t az alváshiány váltja ki.
Az interiktális periódusban végzett MCG vizsgálatban a betegek 25%-ánál derült ki a normához közeli eredmény. A fő EEG-mintázat egy 3 Hz-es vagy annál nagyobb frekvenciájú (4-5 másodpercenkénti) általános csúcshullám-aktivitás, amely túlnyomórészt szimmetrikus és kétoldali szinkron.
Kezelés. A kezelés hatékonysága JAE-ben lényegesen alacsonyabb, mint DAE-ben. A terápiás remisszió átlagosan a betegek 60% -ánál érhető el, a rohamok jelentős csökkenése - 35%, nincs hatás - 5%. A kezelés valproinsav monoterápiával kezdődik. Az átlagos adag 30-50 mg / kg / nap. Tekintettel arra, hogy JAE-ben rendkívül nagy a GSP kötődés valószínűsége, nem javasolt a szukcinimidekkel történő kezelés megkezdése, illetve monoterápiaként történő alkalmazása. Ha a valproát-monoterápia nem fejt ki jelentős hatást kellően nagy dózisokban, a valproátokat szukcinimidekkel vagy lamictallal kombinálják. A szuximid átlagos dózisa 20 mg/kg/nap; Lamictal - 1-5 mg / kg / nap.
Epilepszia izolált generalizált görcsrohamokkal
Az izolált GSP-vel járó epilepsziát az idiopátiás generalizált epilepszia szindrómájaként határozzák meg, amely a rohamok egyetlen típusában - aura hiányában és az EEG-re való egyértelmű összpontosításban - a primer generalizált tónusos-klónusos görcsös paroxizmusban nyilvánul meg.
A betegség debütálása nagyon széles kortartományban figyelhető meg: 1 és 30 év között, maximum a pubertás időszakában (átlagosan -13,5 év).
Klinikailag a GSP hirtelen (aura nélküli) eszméletvesztésben nyilvánul meg leeső betegekkel, görcsökkel, szemgolyó visszahúzódásával, pupillatágulattal. Először egy rövid tónusos fázis következik be, amely hosszabb klónos fázisba megy át, majd a támadást követő kábítás következik. A GSP időtartama 30 másodperctől 10 percig terjed (átlagosan 3 perc). A rohamok gyakorisága alacsony - évente egyszeritől havi 1-ig, sorozatos és állapotos kurzusra való hajlam nélkül. A legtöbb roham az ébredés és ritkábban az elalvás időszakára korlátozódik. A legjelentősebb kiváltó tényező az alváshiány és a hirtelen kényszer ébredés. A perimenstruációs időszakban fokozódhat a görcsrohamok száma.
EEG vizsgálat az interiktális időszakban a betegek felénél (!) A normál tartományon belül lehet. Általános, 3 Hz-es és nagyobb frekvenciájú csúcshullám-aktivitás jellemzi, gyakran amplitúdó-aszimmetriával vagy bifrontális dominanciával. Különféle regionális minták azonosíthatók.
Kezelés. A betegek 75-80%-ában remisszió érhető el. Az alap gyógyszerek a karbamazepin és a valproát. Az EEG általános csúcs-hullámaktivitása hiányában a kezelés karbamazepinnel kezdődik, amely hatékonyabb, mint a valproát. Amikor generalizált görcsös abszansok vagy myoklonus paroxizmákhoz kapcsolódnak, vagy ha generalizált csúcshullám-aktivitás jelenik meg az EEG-n, az alap gyógyszer csak valproátok. A karbamazepin átlagos adagja 15-25 mg / kg / nap. 3 adagban; valproátok 20-50 mg / kg / nap. 3 adagban. A tartalék gyógyszerek közé tartoznak a barbiturátok (fenobarbitál 1,5-3,0 mg/ttkg/nap 1-2 adagban; hexamidin, benzonal), a hidantoinok (difenin 4-8 mg/kg/nap 2 adagban). Ritka rezisztens esetekben kombinációk lehetségesek: karbamazepin + valproát; karbamazepin + lamotrigin, karbamazepin + barbiturátok; valproátok + barbiturátok. Nem megfelelő kezelés esetén a GSP-hez köthetők az abszanszok vagy myoclonus rohamok, amelyek juvenilis myoclonus epilepsziává alakulnak át.
Fiatalkori myoclonus epilepszia
A juvenilis myoclonus epilepszia (JME) az idiopátiás generalizált epilepszia egyik formája, amelyre jellemző a serdülőkor masszív kétoldali myoclonus rohamok előfordulásával, főként a kézben, a betegek felébredését követő időszakban. A JME az epilepszia egyik első formája, amely ismert genetikai hibával rendelkezik. Két lókuszos öröklődési modellt (domináns-recesszív) feltételezünk, ahol a domináns gén a 6. kromoszóma rövid karján található.
A JME debütálása 7 és 21 év között változik, maximum 11-15 éves korig. A betegség korai életkorban kezdõdhet abszansz rohamokkal vagy GSP-vel, amit a pubertásban myoklonusos rohamok követnek. A myoklonusos rohamokat különféle izomcsoportok villámgyors rángatózásai jellemzik; gyakrabban kétoldaliak, szimmetrikusak, egyszeresek vagy többszörösek, változó amplitúdójúak. Főleg ben találhatók vállövés a kezek, főleg a feszítő izomcsoportokban. A támadások során a betegek tárgyakat ejtenek ki a kezükből, vagy messzire dobják oldalra. A betegek 40%-ánál a myoklonusos rohamok a láb izmait is elfogják, miközben a beteg hirtelen ütést érez a térde alatt, és enyhén megkucorodik vagy elesik (mioklónikus-asztatikus rohamok); majd azonnal felkel. A tudat a rohamok alatt általában megmarad. A myoklonusos rohamok reggel, a beteg felébredése után jelentkeznek vagy gyakoribbá válnak. Az esetek 90% -ában GSP-ébresztéssel, 40% -ban pedig hiányzásokkal kombinálják. A rohamok fő provokáló tényezői az alváshiány és a hirtelen kényszer ébredés. A JME betegek körülbelül 1/3-a (gyakrabban nő) mutat fényérzékenységet.
Az EEG-n az epilepsziás aktivitást a betegek 85%-ánál észlelik az interiktális időszakban. A legjellemzőbb általánosított gyors (4 Hz-től és afeletti) policsúcs-hullám aktivitás rövid kitörések formájában. 3 Hz-es csúcshullám-aktivitás megjelenése is lehetséges.
Kezelés. A gyógyszeres terápia mellett szigorúan be kell tartani az alvás és az ébrenlét betartását; kerülje az alvásmegvonást és a fotostimulációs tényezőket a mindennapi életben. Az alapkészítmények kizárólag a valproesav származékai. Az átlagos napi adag 40-60 mg/kg, elégtelen hatékonyság esetén politerápia írható elő: valproát + suxilep (rezisztens hiányokkal); valproát + fenobarbitál vagy hexamidin (rezisztens GSP-vel); valproát + lamotrigin vagy klonazepam (rezisztens mioklónusos rohamokkal és súlyos fényérzékenységgel).
A betegek 75%-ánál és a legtöbb esetben a valproát monoterápia esetén teljes orvosi remisszió érhető el. Később azonban, az AED eltörlésével a betegek felénél relapszusokat észlelnek. Az epilepszia ezen formájával a remisszió kezdetétől számított legalább 4 év elteltével ajánlatos az AED-t törölni.
Jóindulatú gyermekkori parciális epilepszia centrális-temporális csúcsokkal (rolandi epilepszia).
A rolandi epilepszia (RE) egy idiopátiás részleges gyermekkori epilepszia, amelyet túlnyomórészt rövid hemifaciális motoros éjszakai rohamok jellemeznek, amelyeket gyakran szomatoszenzoros aura és tipikus EEG-elváltozások előznek meg.
Az RH debütálása 2 és 14 év közötti korosztályban változik. Az esetek 85%-ában a rohamok 4-10 éves korban kezdődnek, maximum 9 éves korban.
Vannak egyszerű részleges (motoros, szenzoros, vegetatív), összetett részleges (motoros) és másodlagos generalizált görcsrohamok. A legjellemzőbbek az egyszerű részleges motoros és/vagy szenzoros paroxizmusok. Jellemző a szomatoszenzoros aurából érkező roham: bizsergő érzés, zsibbadás az egyik oldalon a garat, a nyelv és az íny területén. Ezután motoros jelenségek jelennek meg: az arc, az ajkak, a nyelv, a garat, a gége izomzatának egyoldalú tónusos, klónos vagy tónusos-klónusos görcsök; pharyngo-oralis rohamok, amelyek gyakran társulnak anarthriával és hypersalivációval. Ugyanakkor egy álomban a betegek sajátos torokhangokat adnak ki, például "gurgulázó", "görcsölő", "gargarizáló". A betegek 20%-ánál a rohamok átterjedhetnek az arc izmaiból a homolaterális karba (brachiofaciális rohamok), és az esetek körülbelül 8%-ában a lábat érintik. A betegség előrehaladtával a rohamok iránya változhat. Másodlagos generalizált görcsrohamok a RE-ben szenvedő betegek 20-25%-ánál figyelhetők meg. A RE-ben a támadások időtartama rövid: néhány másodperctől 2-3 percig. A gyakoriság általában alacsony - évente átlagosan 2-4 alkalommal. A betegség kezdetét követő első hónapokban a rohamok gyakoribbak lehetnek, de idővel egyre ritkábban, kezelés nélkül is. A RE paroxizmusok "mereven" kapcsolódnak az alvás-ébrenlét ritmusához. A legjellemzőbbek az éjszakai rohamok, amelyek főként elalvás és ébredés során jelentkeznek. Csak a betegek 15-20% -ánál figyeltek meg rohamokat alvásban és ébrenlétben is.
Az EEG-n az interiktális periódusban nagy frekvenciával jellegzetes "rolandi" csúcshullám komplexek mutathatók ki, szükségszerűen ép alapaktivitás mellett. Ezek a komplexek lassú kétfázisú, nagy amplitúdójú csúcsok vagy éles hullámok (150-300 μV), amelyeket gyakran lassú hullámok követnek, körülbelül 30 ms teljes időtartammal. Ezek a komplexek az EKG ORS hullámokhoz hasonlítanak. A rolandi komplexek általában a központi és időbeli régióban lokalizálódnak; előfordulhat egyoldalúan (általában a hemifacialis rohamokkal kontralaterálisan) és kétoldalilag függetlenül. Jellemző az EEG-minták instabilitása, az egyik felvételről a másikra való változékonyságuk.
Kezelés. Az alap gyógyszer a valproát. Az átlagos adag 20-40 mg / kg / nap. 3 adagban. Hatástalansággal - a karbamazepinre való áttérés -10-20 mg / kg / nap. 2-3 adagban. A politerápia nem megengedett!
Az esetek közel 100%-ában teljes terápiás remisszió érhető el. 14 éves kor után a rohamok eltűnnek (kezeléssel vagy spontán módon) a betegek 93% -ánál, és 16 év után - 98%. Tekintettel az abszolút kedvező prognózisra, egyes szerzők azt javasolják, hogy ne írjanak fel kezelést az EK megállapított diagnózisára. Ez a nézőpont vitatható.
Idiopátiás részleges epilepszia occipitalis paroxizmákkal
Az idiopátiás parciális epilepszia occipitalis rohamokkal (jóindulatú occipitalis epilepszia (BE)) a gyermekkori idiopátiás lokalizációval összefüggő epilepszia egyik formája, amelyet egyszerű részleges rohamok jellemeznek látászavarokkal és specifikus csúcshullám-aktivitás jelenléte az EEG occipitalis vezetékeiben. .
A betegség 2-12 éves korban kezdődik, a debütálás két csúcsa - körülbelül 3 és 9 év. Jellemzőek az egyszerű részleges szenzoros paroxizmusok látászavarokkal. Egyszerű vizuális hallucinációk, fotopszia, vizuális illúziók (makró, mikropszia) jellemzik. Átmeneti amaurosis és homonim kvadráns hemianopsia fordulhat elő. A támadás során gyakran figyelhető meg egy versengő komponens a szem és a fej heves elfordításával. Az occipitalis lebenyre fókuszálva gyakran megfigyelhető a gerjesztés elülső (a temporális és frontális lebenybe) történő besugárzása összetett szerkezeti hallucinációk megjelenésével; a tudat kikapcsolása és a másodlagos generalizált görcsrohamok előfordulása. Jellemző az alvás közbeni rohamok megjelenése, különösen akkor, amikor a betegek felébrednek. A rohamokat gyakran migrénes tünetek kísérik: fejfájás és hányás. A kisgyermekeknél az első rohamok a legsúlyosabbak és elhúzódóak (akár több óráig vagy akár napig is).
Az EEG a nagy amplitúdójú csúcshullám aktivitás megjelenését mutatja az egyik occipitalis elvezetésben vagy biooccipitálisan függetlenül. A minták morfológiája hasonlít a Rolandi epilepsziára. Jellemző az epiaktivitás megszűnése nyitott szemmel végzett EKG-felvétel során.
Kezelés. A választott gyógyszerek a karbamazepin származékai. Az átlagos napi adag körülbelül 20 mg/kg. Hatékonyság hiányában valproátokat használnak - 30-50 mg / kg / nap. Tartalék gyógyszer fenitoin - 3-7 mg / kg / nap. A kezelést csak monoterápiával végezzük. A rezisztens eseteket meg kell különböztetni a tünetekkel járó occipitalis epilepsziától. Az esetek 95% -ában teljes terápiás remisszió figyelhető meg. Ugyanakkor a rohamokat nehezebb megállítani, és az AED dózisai magasabbak, mint a Roland-epilepsziában.
West szindróma
A West-szindróma (WS) a korai gyermekkori generalizált epilepszia rezisztens formája, amelyet infantilis görcsök, pszichomotoros retardáció és specifikus MCG-változások (hipritmia) jellemeznek. A megnyilvánulás életkori csúcsa 4-7 hónap. Léteznek tüneti (agyi fejlődési rendellenességek, szklerózis gumós, perinatális encephalopathia, tezauriszmózisok stb.) és kriptogén formák. A tünetekkel járó formában a gyermekek pszichomotoros fejlődése általában a születéstől, a kriptogén formában a rohamok kezdetétől szenved.
A csecsemőkori görcsök a nyak, a törzs, a végtagok izomzatának hirtelen összehúzódásában nyilvánulnak meg, amelyek általában kétoldalúak és szimmetrikusak. A legjellemzőbb hajlító görcsök ("Salaam támadásai") a nyak, a törzs, a karok hajlításával; a lábak hajlítása, addukciója és felemelése. A támadások rövidek, sorozatban csoportosulnak; gyakran közvetlenül a betegek felébresztése után jelentkeznek.
A neurológiai státuszban a mentális és motoros fejlődés súlyos késése, gyakran tetrapiramidális tünetek jelentkeznek.
Az EEG-n hypsarrhythmiát állapítanak meg - nagy amplitúdójú szabálytalan, gyengén szinkronizált aritmiás lassú hullámok tüskés kisülésekkel.
Kezelés Valproáttal, vigabatrinnal (Sabril) vagy ACTH-val kezdődik. Az SV kriptogén eseteiben az ACTH-t (vagy Sinakten-depot) 0,1 mg/kg/nap dózisban alkalmazzák. vagy prednizolon - 2-5 mg / kg / nap. Tüneti SV-valproáttal (50-100 mg / kg / nap és több) monoterápiaként vagy ACTH-val kombinálva. Az elmúlt években sok szerző szerint a vigabatrin 100 mg/ttkg/nap dózisban történő alkalmazása javasolt. A vigabatrin a választott gyógyszer a gumós szklerózis okozta SV kezelésében. A monoterápia hatásának hiányában az alapvető AED-ket lamotriginnel, karbamazepinnel vagy benzodiazepinekkel kombinálják.
A betegség prognózisa súlyos, mind a rohamok, mind a pszichomotoros fejlődés tekintetében. A legtöbb gyermek fogyatékos, és nem tud önálló életet élni. Idővel az SW átalakul SLH-vé (az esetek 1/3-a) vagy multifokális epilepsziává.
Lennox-Gastaut szindróma
A Lennox-Gastaut-szindróma (LSS) egy gyermekkori epilepsziás encephalopathia, amelyet rohampolimorfizmus, kognitív károsodás, specifikus EEG-változások és terápiával szembeni rezisztencia jellemez. Az SLH gyakorisága körülbelül 5% az epilepszia minden formája között gyermekeknél és serdülőknél; a fiúk gyakrabban betegek.
A betegség főként 2-8 éves korban (általában 4-6 évesen) debütál. Ha az SLH a West-szindrómából való átalakulás során alakul ki, akkor 2 lehetőség lehetséges:
1. A csecsemőkori görcsök látens időszak hiányában tónusos rohamokká alakulnak, és simán átmennek SLH-ba.
2. A csecsemőkori görcsök eltűnnek; a gyermek pszichomotoros fejlődése valamelyest javul; Az EEG-kép fokozatosan normalizálódott. Ezután jön a látens időszak, amelynek időtartama különböző betegeknél változik; hirtelen esések, atipikus hiányzások és diffúz lassú csúcshullám-aktivitás az MCG-n megnövekszik.
Az SLH-t a rohamok hármasa jellemzi: esések paroxizmusa (atonikus és myo-clonus-asztatikus); tónusos rohamok és atipikus hiányzások. A tónusos, myoclonus vagy atonikus (negatív myoclonus) rohamok által okozott hirtelen esések legjellemzőbb rohamai. A tudat megőrizhető vagy rövid időre kikapcsolható. Az esés után nincsenek görcsök, a gyermek azonnal felkel. A gyakori esések súlyos traumához és a betegek rokkantságához vezetnek.
A tónusos rohamok axiálisak, proximálisak vagy teljesek; szimmetrikus vagy egyértelműen oldalirányú. A rohamok közé tartozik a nyak és a törzs hirtelen meghajlítása, a karok félig hajlított vagy nyújtható felemelése, a lábak nyújtása, az arcizmok összehúzódása, a szemgolyók forgó mozgása, apnoe, az arc kipirulása. Előfordulhatnak nappal és különösen gyakran éjszaka is.
Az atipikus hiányzások az SLH-ra is jellemzőek. Megnyilvánulásaik változatosak. A tudat megsértése hiányos. A motoros és beszédtevékenység bizonyos foka fennmaradhat. Van hipomimia, nyálfolyás; a szemhéj myoclonusa, száj; atonikus jelenségek (a fej a mellkasra esik, a száj rés). Az atipikus távolléti rohamok általában az izomtónus csökkenésével járnak, ami a test egyfajta „lágyulását” okozza, kezdve az arc és a nyak izmaitól.
A neurológiai állapotban a piramis elégtelenség, koordinációs zavarok megnyilvánulásai vannak. Jellemző az intelligencia csökkenése, amely azonban nem éri el a súlyos mértéket. Az intellektuális hiányosság korai életkortól kezdve, a betegséget megelőzően (tünetekkel járó formák) vagy közvetlenül a rohamok megjelenése után alakul ki (kriptogén formák).
Az esetek nagy százalékában végzett EEG-vizsgálat szabálytalan diffúz, gyakran amplitúdó-aszimmetriával, lassú csúcshullám-aktivitást tár fel ébrenlét alatt 1,5-2,5 Hz-es frekvenciával, és gyors, ritmikus kisüléseket, körülbelül 10 Hz-es gyakorisággal alvás közben.
A neuroimaging során az agykéregben különböző szerkezeti rendellenességek léphetnek fel, köztük malformációk: corpus callosum hypoplasia, hemimegalencephalia, corticalis dysplasia stb.
A kezelésben Az FMS-nek kerülnie kell a kognitív funkciókat elnyomó gyógyszereket (barbiturátok). Az SLH kezelésére leggyakrabban használt gyógyszerek a valproát, a lamotrigin, a karbamazepin és a benzodiazepinek. A kezelést valproinsav-származékokkal kell kezdeni, fokozatosan növelve azokat a maximálisan tolerálható dózisig (70-100 mg / kg / nap és a felett). A karbamazepin hatásos tónusos rohamokban – 15-30 mg/ttkg/nap, de növelheti a hiányzások és a myoklonus paroxizmusok gyakoriságát. Számos beteg reagál a karbamazepin adagjának emelésére a görcsrohamok paradox növekedésével. A benzodiazepinek minden típusú rohamra hatással vannak, de ez a hatás átmeneti. A benzodiazepin csoportban a klonazepamot, a klobazámot (frizium) és a nitrazepamot (radedorm) használják. A Suxilep hatásos lehet atipikus hiány esetén (de nem monoterápiaként). Kimutattuk a valproát és a lamiktál kombinációjának (1-5 mg/ttkg/nap és több) nagy hatékonyságát (5. táblázat). Ez a terápia a legoptimálisabb mind a hatékonyság, mind a tolerálhatóság szempontjából (nem csökkenti a kognitív funkciókat). Az Egyesült Államokban széles körben használják a valproát és a felbamát (Talox) kombinációját.
Az SLH prognózisa súlyos. A rohamok stabil kontrollja csak a betegek 5-15% -ánál érhető el. A myoklonusos rohamok túlsúlya és az agy durva szerkezeti elváltozásainak hiánya prognosztikailag kedvező; negatív tényezők a tónusos rohamok dominanciája és a súlyos intellektuális hiány.
Tünetekkel járó részleges epilepszia
Az epilepszia tüneti részleges formáiban az agykéreg szerkezeti változásait észlelik. A fejlődésüket meghatározó okok sokfélék, és két fő csoportba sorolhatók: perinatális és posztnatális tényezők. Az anamnézisben előforduló perinatális encephalopathiát a betegek 35% -ánál észlelték; posztnatális tényezők közül a neuroinfekciókat, a craniocerebralis sérüléseket, az agykéreg daganatait kell megjegyezni.
A tünetekkel járó részleges epilepsziában a rohamok megjelenése széles életkorban változik, a maximum az óvodás korban jelentkezik. Ezeket az eseteket a neurológiai állapot változásai jellemzik, gyakran az intelligencia csökkenésével kombinálva; regionális mintázatok megjelenése az EEG-n, a rohamok rezisztenciája az AED-vel szemben. Az epilepsziának vannak tüneti részleges formái: temporális, frontális, parietális és occipitalis. Az első kettő a leggyakoribb, és az esetek 80%-át teszik ki.
Tünetekkel járó temporális lebeny epilepszia
A VE klinikai megnyilvánulásai rendkívül változatosak. Egyes esetekben atípusos lázas rohamok előzik meg a betegség kialakulását. Az SE egyszerű, összetett parciális, másodlagos generalizált rohamokban vagy ezek kombinációjában nyilvánul meg. Különösen jellemző az összetett parciális rohamok jelenléte, amelyek tudatzavarral együtt fordulnak elő, megőrzött, de automatizált motoros aktivitással kombinálva. A komplex parciális rohamok automatizmusai lehetnek egyoldalúak, a lézió homolaterális oldalán fordulnak elő, és gyakran társulnak az ellenoldali kéz disztóniás elhelyezésével. Az AE amygdalo-hippocampus (paleokortikális) és laterális (neokortikális) epilepsziára oszlik.
Az amygdalo-hippocampus temporális lebeny epilepsziát a rohamok előfordulása jellemzi elszigetelt tudatzavarral. Megdermednek a maszkszerű arcú, tágra nyílt „csodálkozó” szemű, merev tekintetű betegek. Ilyenkor különféle vegetatív jelenségek állapíthatók meg: az arc elfehéredése, pupillák kitágulása, izzadás, tachycardia. Az elszigetelt tudatzavarral járó SPP 3 típusa létezik:
a tudat kikapcsolása lefagyással és a motoros és mentális tevékenység hirtelen megszakításával;
a tudat kikapcsolása a motoros tevékenység megszakítása nélkül;
a tudat kikapcsolása lassú eséssel ("puhaság") görcsök nélkül ("temporális syncope").
Jellemzőek a vegetatív-zsigeri paroxizmusok is. A rohamok hasi diszkomfort érzéssel, köldök- vagy epigastrium-fájdalommal, hasi zörgésben, székletürítési késztetésben, gázfolyásban (epigasztrikus rohamok) nyilvánulnak meg. Talán egy "felszálló epilepsziás érzés" megjelenése, amelyet a betegek fájdalomként, gyomorégést, hányingert írnak le, amely a hasból jön és a torok felé emelkedik, összenyomódás érzésével, a nyak összenyomódásával, gombóc megjelenésével a torokban, amit gyakran követnek. eszméletvesztés és görcsök miatt. Amikor az amygdala komplexum részt vesz a folyamatban, félelem, pánik vagy dührohamok lépnek fel; a horog irritációja szagló hallucinációkat okoz. Károsodott mentális funkciókkal járó rohamok lehetségesek (álomállapotok, már látott vagy soha nem látott stb.).
Az oldalirányú VE hallás-, látás- és beszédkárosodással járó rohamokban nyilvánul meg. Élénk színű strukturális (az occipitalis epilepsziával ellentétben) vizuális hallucinációk, valamint összetett hallási hallucinációk megjelenése jellemzi. Az EE-ben szenvedő nők körülbelül 1/3-a számol be a görcsrohamok számának növekedéséről a perimenstruációs időszakban.
A VE-s gyermekek neurológiai vizsgálata gyakran mikroszkópos képet mutat fokális tünetek, a fókusz ellenoldali: a 7. és 12. agyideg működésének elégtelensége a centrális típus szerint, az ínreflexek felélénkülése, kóros reflexek megjelenése, enyhe koordinációs zavarok stb. főleg intellektuális-mnesztikus vagy érzelmi-személyi zavarokban nyilvánul meg; kifejezett memóriazavarok megjelenése jellemzi. Az intelligencia megőrzése elsősorban az agy szerkezeti változásainak természetétől függ.
Az EEG-vizsgálat csúcshullámú vagy gyakrabban tartós regionális lassú hullámú (théta) aktivitást mutat a temporális elvezetésekben, amelyek általában előre terjednek. A betegek 70% -ánál a háttérfelvétel fő tevékenységének kifejezett lassulása észlelhető. A legtöbb betegnél idővel az epilepsziás aktivitás bitemporálisan észlelhető. A mediobazális régiókban lokalizált fókusz azonosításához előnyösebb az invazív sphenoidális elektródák használata.
A neuroimaging különféle makrostrukturális rendellenességeket tár fel az agyban. Az MRI gyakori lelete a mediális temporális (incisuralis) szklerózis. Gyakran előfordul a barázdák lokális kiterjedése, az érintett halántéklebeny térfogatának csökkenése, részleges ventriculomegalia.
Kezelés A RE nehéz feladat; sok beteg ellenáll a terápiának. Az alapkészítmények a karbamazepin származékai. Az átlagos napi adag 20 mg/kg. Ha nem hatékony, növelje az adagot 30 mg / kg / napra. és a felett a pozitív hatás megjelenéséig vagy a mérgezés első jeleiig. Ha nincs hatás, a karbamazepin alkalmazását fel kell hagyni, helyette fenitoint kell felírni összetett parciális rohamok esetén, vagy valproátot másodlagos generalizált paroxizmák esetén. A difenin dózisa VE kezelésében 8-15 mg/kg/nap, valproát -50-100 mg/kg/nap. A monoterápia hatásának hiányában politerápia alkalmazható: karbamazepin + valproátok, karbamazepin + lamiktál, karbamazepin + fenobarbitál, fenobarbitál + difenin (ez utóbbi kombináció kevésbé előnyös, és jelentős figyelem- és memóriacsökkenést okoz, különösen gyermekek). A nőknél az AED alapterápiája mellett a menstruációs epilepsziában különösen hatékony nemi hormonok alkalmazhatók. Az oxiprogeszteron-kapronát 12,5%-os oldatát 1-2 ml intramuszkulárisan egyszer, a menstruációs ciklus 20-22. napján alkalmazzák.
A prognózis a strukturális agykárosodás természetétől függ. Az életkor előrehaladtával a legtöbb betegnél tartós mentális zavarok alakulnak ki, amelyek jelentősen megnehezítik a szociális alkalmazkodást. Általánosságban elmondható, hogy a TE-s betegek körülbelül 30%-a rezisztens a hagyományos antiepileptikus terápiára, és idegsebészeti beavatkozásra jelöltek.
Tünetekkel járó frontális epilepszia
A frontális epilepszia (LE) klinikai tünetei változatosak. A betegséget egyszerű és összetett parciális rohamok, valamint – ami különösen jellemző – másodlagosan generalizált rohamok manifesztálják. A PE következő formáit különböztetjük meg: motoros, operkuláris, dorsolaterális, orbitofrontális, elülső frontopoláris, cingular, a járulékos motoros zónából eredő.
Motoros paroxizmusok akkor fordulnak elő, ha az elülső központi gyrus irritálódik. Jackson-féle rohamok jellemzik, amelyek a fókusz ellenoldalán alakulnak ki. A rohamok túlnyomórészt klónikus jellegűek, és emelkedő (láb-kar-arc) vagy leszálló (arc-kar-láb) menetben terjedhetnek; egyes esetekben másodlagos általánosítással. A paracentrális lebenyekben lévő fókusz esetén görcsök figyelhetők meg az azonos oldali végtagban vagy kétoldalian. A támadás utáni végtaggyengeség (Todd-bénulás) gyakori PE-jelenség.
Operkuláris rohamok akkor fordulnak elő, ha a gyrus inferior frontális operkuláris zónája irritálódik a temporális lebeny találkozásánál. A rágási, szopási, nyelési mozdulatok, csapkodás, nyalás, köhögés rohamokban nyilvánul meg; fokozott nyálfolyás jellemzi. Előfordulhat azonos oldali arcrángás, beszédzavar vagy önkéntelen hangzás.
Dorsolaterális rohamok akkor fordulnak elő, ha a felső és alsó frontális gyri irritált. A fej és a szem heves elfordításával járó, ellentétes rohamokban nyilvánul meg, általában az irritáció fókuszával ellentétes oldalon. Az inferior frontális gyrus (Broca központja) hátsó szakaszainak bevonásával motoros afázia paroxizmusa figyelhető meg.
Orbitofrontális rohamok akkor fordulnak elő, ha a gyrus inferior frontális orbitális kérge irritált, és különféle vegetatív-zsigeri jelenségekben nyilvánul meg. Epigasztrikus, kardiovaszkuláris (fájdalom a szív régiójában, pulzusszám változása, vérnyomás), légúti (belégzési nehézlégzés, fulladásérzés, nyaki összehúzódás, "kóma" a torokban) rohamok. Gyakran előfordulnak pharyngo-orális automatizmusok, amelyek fokozott nyálfolyással járnak. Figyelemre méltó a vegetatív jelenségek bősége a rohamok szerkezetében: hyperhidrosis, bőrsápadtság, gyakran arckipirulással, hőszabályozási zavarok stb. Jellemzően összetett parciális (pszichomotoros) rohamok jelentkezhetnek gesztusok automatizmusával.
Elülső (frontopoláris rohamok akkor fordulnak elő, ha a homloklebenyek pólusa irritált. Egyszerű részleges rohamok jellemzik, károsodott mentális funkciókkal. Hirtelen "gondolathiba", "üresség a fejben", zavarodottság érzésében nyilvánulnak meg. vagy fordítva, erőszakos emlék; fájdalmas, fájdalmas érzés, hogy szükség van valamire. Lehetséges heves „gondolatok özönlenek”, „ötletek forgószele” – olyan érzés, amikor hirtelen olyan gondolatok jelennek meg az elmében, amelyek nem kapcsolódnak egymáshoz A betegnek nincs lehetősége megszabadulni ezektől a gondolatoktól a roham végéig.
A cinguláris rohamok a mediális frontális lebenyek elülső cinguláris gyrusából származnak. Ezek túlnyomórészt összetettek, ritkábban egyszerű részleges rohamok a viselkedés és az érzelmi szféra megsértésével. Komplex parciális rohamok jellemzik a gesztusok automatizmusával, az arc kipirulásával, az ijedtség kifejezésével, az azonos oldali pislogó mozgásokkal, és néha az ellenoldali végtagok klónikus görcseivel. Talán paroxizmális diszfórikus epizódok megjelenése rosszindulattal, agresszivitással, pszichomotoros izgatottsággal.
A kiegészítő motoros területről származó rohamokat először Penfield írta le, de csak mostanában rendszeresítették. Ez a roham meglehetősen gyakori típusa, különös tekintettel arra, hogy a frontális lebeny más részein előforduló paroxizmusok gyakran a további motoros területre sugároznak. Jellemző a gyakori, általában éjszakai, egyszerű parciális rohamok váltakozó hemiconvulsiókkal, archaikus mozgásokkal; rohamok a beszéd abbahagyásával, homályos, rosszul lokalizált érzékeny érzések a törzsben és a végtagokban. A részleges motoros rohamok általában tónusos görcsökben nyilvánulnak meg, amelyek az egyik vagy a másik oldalon, vagy kétoldalúan jelentkeznek (generáltnak tűnnek). Tónusos feszültség jellemzi az ellenoldali kar felemelkedésével, a fej és a szemek elfordulásával (úgy tűnik, a beteg a felemelt karját nézi). Leírják a paroxizmális hemiparesissel járó "fék" rohamok előfordulását. Az archaikus mozgások támadásai általában éjszaka fordulnak elő, nagy gyakorisággal (akár 3-10 alkalommal éjszakánként, gyakran minden éjszaka). Jellemzőjük a betegek hirtelen felébredése, sikoly, iszonyat fintora, motoros vihar: karok és lábak hadonászása, boksz, pedálozás (kerékpározásra emlékeztet), medencemozgások (mint a koitusznál), stb. A károsodás mértéke a tudat ingadozik, de a legtöbb esetben a tudat megmarad. Ezeket a rohamokat meg kell különböztetni a hisztérikus és paroxizmális éjszakai rémületektől a gyermekeknél.
PE-ben végzett EEG vizsgálat a következő eredményeket mutatja: normál, csúcshullám aktivitás vagy lassulás (periodikus ritmikus vagy folyamatos) regionálisan a frontális, fronto-centrális vagy fronto-temporális elvezetésekben; bifrontális független csúcshullám központok; másodlagos kétoldalú szinkronizálás; regionális frontális alacsony amplitúdójú gyors (béta) aktivitás. Előfordulhat, hogy az orbitofrontalis, opercularis és kiegészítő motoros területeken elhelyezkedő elváltozások nem mutatnak változást felületi elektródák alkalmazásakor, és mélyelektródák vagy kortikográfia használatát teszik szükségessé. Ha az EEG járulékos motoros zónája érintett, a mintázatok gyakran a rohamokhoz képest azonos vagy kétoldaliak, vagy másodlagos bilaterális Jasper-szinkronizáció jelensége áll fenn.
Kezelés Az LE-t az epilepszia lokalizációval kapcsolatos formáinak terápia általános elvei szerint hajtják végre. A karbamazepin és a difenin a választott gyógyszerek; valproátok, lamotrigin és barbiturátok – tartalék. A valproát különösen hatásos másodlagos generalizált görcsrohamok esetén. A monoterápia hatástalansága miatt politerápiát alkalmaznak - a fenti gyógyszerek kombinációját. A görcsrohamok teljes ellenállása a folyamatban lévő WGA-kezeléssel szemben okot ad a sebészeti beavatkozás kérdésének mérlegelésére.
A PE prognózisa az agy szerkezeti károsodásának természetétől függ. A gyakori, terápiának ellenálló rohamok jelentősen rontják a betegek szociális alkalmazkodását. A kiegészítő motoros területről származó rohamok általában ellenállnak a hagyományos AED-eknek, és sebészeti kezelést igényelnek.
Általános elvek epilepszia kezelése
Jelenleg az epilepszia kezelésére általánosan elfogadott nemzetközi szabványokat dolgoztak ki, amelyeket be kell tartani a kezelés hatékonyságának növelése és a betegek életminőségének javítása érdekében.
Az epilepszia kezelése csak pontos diagnózis felállítása után kezdhető meg. A „preepilepszia” és „az epilepszia megelőző kezelése” kifejezések abszurdak. A legtöbb neurológus szerint az epilepszia kezelését a második roham után kell elkezdeni. Egyetlen roham lehet „véletlen”, láz, túlmelegedés, mérgezés, anyagcserezavarok miatt, és nem kapcsolódik az epilepsziához. Ebben az esetben az AED azonnali felírása nem indokolható, mivel ezek a gyógyszerek potenciálisan erősen mérgezőek, és nem „profilaxis” céljára használják. Így az AED-k csak visszatérő, provokálatlan epilepsziás rohamok (azaz értelemszerűen epilepszia) esetén alkalmazhatók.
Felállították az epilepszia diagnózisát, és az AED felírása mellett döntöttek. A klinikai epileptológiában az 1980-as évek óta szilárdan kialakult a monoterápia elve: az epilepsziás rohamok enyhítését elsősorban egy gyógyszerrel kell elvégezni. Jelenleg teljes mértékben bebizonyosodott a régi koncepció kudarca, amely szerint nagyszámú AED-t írtak fel egyidejűleg kis adagokban. A politerápia csak az epilepszia rezisztens formái és egyidejűleg legfeljebb 3 AED esetén indokolt.
Az AED kiválasztása nem lehet empirikus. Az AED-eket szigorúan az epilepszia formájának és a rohamok természetének megfelelően írják fel. Az epilepszia kezelésének sikerét nagymértékben meghatározza a szindróma diagnózis pontossága (1. táblázat).
Az AEP-ek hozzárendelése a következő időponttól kezdődik: kis adag, fokozatos emeléssel, amíg el nem éri terápiás hatékonyság vagy a mellékhatások első jelei. Ebben az esetben a meghatározó tényező a gyógyszer klinikai hatékonysága és tolerálhatósága (2. táblázat).
Ha az egyik gyógyszer hatástalan, fokozatosan helyettesíteni kell egy másik AED-vel, amely hatékony az epilepszia ezen formájában. Ha az egyik AED hatástalan, lehetetlen azonnal hozzáadni egy második gyógyszert, vagyis áttérni politerápiára anélkül, hogy a monoterápia összes tartalékát felhasználnánk.
Javallatok a vér AEP-tartalmának meghatározására. Az AEP vérszintjének meghatározása a következő esetekben hasznos lehet a klinikai gyakorlatban:
A mérgezés jeleinek megjelenése;
A hatékonyság hiánya megfelelő dózisok alkalmazásakor;
A beteg állapota, jogsértést okozva az AED farmakokinetikája (máj- és vesebetegség, terhesség, korai életkor stb.);
A fenitoin használatának minden esetben ajánlott (nemlineáris farmakokinetika);
Több AED vagy egyéb olyan gyógyszer használata, amelyek megváltoztatják az AED-ek farmakokinetikáját;
Orvosi vizsgálat lefolytatása.
Mindig emlékezni kell arra, hogy nincs egyértelmű közvetlen kapcsolat a gyógyszer klinikai hatékonysága, tolerálhatósága és vérkoncentrációja között. Ebben a tekintetben a hatékonyság és a tolerálhatóság klinikai kritériumának mindig dominálnia kell a laboratóriumi paraméterekkel szemben.
Vita tárgyát képezi az antiepileptikumoktól eltérő gyógyszerek alkalmazása az IE kezelésében. Az általunk vizsgált betegek egy részénél a komplex terápiában vaszkuláris gyógyszereket (cinnarizine, cavinton, sermion, tanakan) alkalmaztak; nootrop (nootropil, pantogam, cogitum, oxybral); metabolikus (Essentiale Forte, folsav) gyógyszerek. A rohamok gyakoriságára és a betegek általános közérzetére gyakorolt hatásukat nem elemezték. A külföldi kutatók abszolút többsége szerint ezeknek a csoportoknak a gyógyszerei nincsenek hatással az epilepszia lefolyására, és ebben a betegségben nem alkalmazzák. Bizonyos esetekben azonban, amikor az epilepsziát fejfájással, memória- és koncentrációs zavarokkal kombinálják, indokolt lehet az AED-k toxikus hatása, érrendszeri, nootrop és metabolikus gyógyszerek alkalmazása. Nem igazolható azonban egyes orvosok "kóros" makacssága, akik 5-8 különböző gyógyszert, például vizelethajtót, felszívódó szert, vitamint stb. írnak fel a betegeknek. minden nélkül józan ész. Minden gyógyszer kinevezését szigorúan indokolni kell.
A kezelés megvonásának elvei
Az AED 2,5-4 év teljes rohamhiány után törölhető. A klinikai kritérium (rohamok hiánya) a terápia abbahagyásának fő kritériuma. Az epilepszia legtöbb idiopátiás formájával a gyógyszer megvonása 2,5 (rolandi epilepszia) - 3 év remisszió után hajtható végre. Súlyos rezisztens formákban (Lennox-Gastaut szindróma, tüneti parciális epilepszia), valamint juvenilis myoclonus epilepsziában ez az időszak 3-4 évre nő. 4 éves teljes terápiás remisszió esetén a kezelést minden esetben meg kell szakítani. A kóros elváltozások jelenléte az EEG-ben vagy a betegek pubertása nem olyan tényező, amely rohamok hiányában 4 évnél hosszabb ideig késlelteti az AED megvonását.
MINT. Petrukhin, K. Yu. Mukhin, M.I. Medvegyev
A Gyermekgyógyászati Kar Idegbetegségek Tanszéke (vezető Prof. A.S.
Petrukhin) Orosz Állami Orvostudományi Egyetem, Moszkva
Az epilepszia napjaink egyik legsürgetőbb problémája.
gyermekneurológia. A betegség gyakorisága a gyermekpopulációban legfeljebb
0,5 0,75%. Az epilepszia világméretű probléma; az összetettben
morbiditás, a harmadik helyen áll (után cukorbetegség), szintén
a neurológiai morbiditás szerkezetében (az összes idegrendszeri betegség 19% -a
rendszerek). Riasztó, hogy az epilepszia előfordulása folyamatosan nő
tüneti formák miatt növekszik. az epilepszia probléma
pontos szindróma diagnózis és kezelés. Modern osztályozás
epilepszia, epilepsziás szindrómák és hasonló rendellenességek körülbelül 40-et különböztetnek meg
az epilepszia különböző formái, eltérő klinikai tünetek, elvek
terápia, prognózis.
Az epilepszia debütálása főleg gyermekkorban figyelhető meg (kb. 75%
minden esetben). A gyermekkori epilepsziát nagy szám jellemzi
kezeléssel szemben rezisztens formák és rohamok polimorfizmusa, valamint, különösen
fontos, gyerekkorban volt sok homályos fájdalomroham, köldök
kólika, ájulás, acetonémiás hányás rejtőzhet álcázva
ezek a megnyilvánulások szerves természetű epilepsziás rohamok, amelyekre
Jackson, Specht és Livingston is rámutatott. Az epilepszia azonban nem
a kirekesztés diagnózisa legyen, amikor nincs más
diagnosztikai magyarázatok. Epilepsziás rohamokban szenvedő gyermekeknél,
funkcionális zavarok gyorsan fejlődnek, amelyek aztán átalakulnak
tartós változások a jellemben, a memóriában, a figyelemben, a viselkedésben és az iskolai teljesítményben.
Megjegyzendő, hogy az epilepszia diagnózisának és kezelésének területén a
drámai helyzet. Az epilepszia diagnózisa nem felel meg a modernnek
a rohamtípusok és az epilepszia formáinak osztályozására vonatkozó nemzetközi elvek. Gyakran
nem epilepsziás jelenségek és állapotok (például alvajárás, éjszakai rettegés,
konverziós rohamok) epilepsziának tekintik. Néhány szakértő
az epilepsziára extrapolálva, és a rendellenesség epilepsziás jelenségének tekintik,
az alapbetegséggel (viselkedési zavarok, migrén, enuresis,
pszichopatológiai jelenségek betegeknél és hozzátartozóiknál a régi szerint
az epilepsziás kör betegségeiként megjelölt fogalmak). Az ilyen betegek
Az epilepszia elleni gyógyszereket (AED) évek óta szedik anélkül, hogy a kívánt hatást elérte volna. Tovább
Valóban, mint minden többtényezős betegségnél, ami az
epilepszia, a betegek törzskönyvében és magában a betegben is számos megtalálható
nem epilepsziás jellegű paroxizmális rendellenességek.
A neurofarmakológia rohamos fejlődése az elmúlt évtizedekben, az újak szintézise
rendkívül hatékony antiepileptikumok, az epilepszia kezelésének számos elvének alapvető felülvizsgálata
Az epilepsziát gyógyítható betegségek közé sorolták.
A világ vezető antiepileptikus központjainak általánosított adatai szerint
szenvedő betegek 80-85%-ában kifejezett terápiás hatás érhető el
epilepszia. Jelenleg az epilepszia kezelésének fő elve lehet
a következőképpen fogalmazva: maximális terápiás hatékonyság at
minimális mellékhatások. Az epilepsziás betegeknek muszáj
epilepszia elleni szereket használnak éveken át. Ennek köszönhetően
a folyamatos antikonvulzív terápia fontos követelménye a hiánya
negatív hatással van a betegek életminőségére.
Az epilepszia kezelése csak a pontos megállapítása után kezdhető meg
diagnózis. Az epilepszia előtti és az epilepszia profilaktikus kezelése kifejezések
abszurd. A legtöbb szakértő szerint az epilepszia kezelésének kell lennie
visszaesés után kezdődik. Egyetlen paroxizmus is véletlen lehet,
láz, túlmelegedés, mérgezés, anyagcsere miatt
rendellenességek, és nem kapcsolódnak az epilepsziához. Ebben az esetben azonnali időpont egyeztetés
antikonvulzív szerek nem indokolhatók, mivel ezek a gyógyszerek igen
potenciálisan erősen mérgezőek, és nem használják profilaktikus célokra.
Az epilepszia elleni terápia kijelölése az első roham után lehetséges
a következő jelek kombinációjának jelenléte:
Az 1980-as évektől az az elv, hogy
monoterápia: az epilepsziás rohamok enyhítését kell végezni
túlnyomórészt egy gyógyszerrel. A kromatográfiás módszerek megjelenésével
a vér görcsoldó szerek szintjének meghatározása során nyilvánvalóvá vált, hogy sok
antikonvulzív szerek kölcsönös antagonizmussal és egyidejű
alkalmazása jelentősen gyengítheti mindegyik görcsoldó hatását. Kivéve
Ezenkívül a monoterápia alkalmazása elkerüli a súlyos mellékhatások előfordulását.
megnyilvánulások, amelyek gyakorisága jelentősen megnő több kinevezésével
drogokat egyszerre. A politerápia (2 gyógyszer) alkalmazása csak ben lehetséges
a monoterápia abszolút hatástalansága esetén. Az AEP használata lehet
csak elszigetelt esetekben végezzük az epilepszia rezisztens formáival, és kell
erősen indokolt legyen. Több mint 3 görcsoldó egyidejű alkalmazása
epilepszia kezelésében kategorikusan elfogadhatatlan!
Az epilepszia kezelését az epilepszia formájától függően kell elvégezni, ill
nem a rohamok természetéről. Például myoklonus paroxizmusok fordulnak elő
juvenilis myoclonus epilepsziával, Lennox Gastaut szindrómával, progresszív
myoclonus epilepszia stb.; ezekre a formákra vonatkozó terápiás megközelítések és prognózis
alapvetően más.
A kezelés az epilepszia ezen formájának alapgyógyszerével kezdődik. itthon
az adag körülbelül 1/4-e az átlagos terápiás dózisnak. Jóval
a gyógyszer tolerálhatósága miatt az adagot az átlag körülbelül 3/4-ére emelik
terápiás 2 3 hétig. Hatás hiányában vagy elégtelensége esetén az adag
növelje az átlagos terápiás értékre. A terápiás hatás hiányában
adagot 1 hónapon belül, a gyógyszer adagjának további fokozatos emelése szükséges
kifejezett pozitív hatás elérése vagy mellékhatások megjelenése.
Terápiás hatás és a mérgezés jeleinek megjelenése hiányában
a gyógyszert fokozatosan felváltja egy másik. A kifejezett kézhezvételét követően
értékelni kell a terápiás hatást és a mellékhatások jelenlétét
az utóbbi természetét és súlyosságát, és döntsön a kezelés folytatásáról
vagy gyógyszerszubsztitúció. A barbiturátok és benzodiazepinek pótlását el kell végezni
fokozatosan 2-4 hét alatt vagy tovább, kifejezett elvonási szindróma jelenléte miatt.
A többi AED cseréje 1-2 hét alatt gyorsabban elvégezhető. Fokozat
a gyógyszer hatékonyságát csak a pillanattól számított 1 hónap elteltével lehet megtenni
kezdd el szedni.
| Ezért az epilepszia kezelése számos feltétel mellett hatékony lehet: - a roham típusának pontos osztályozása és az epilepszia formájának megállapítása; – az AED-k használata a tevékenységük jellegének megfelelően, megállapított klinikai vizsgálatok szerint. A gyógyszer megválasztása a roham típusától és a az epilepszia formái; – az AED adagjának szigorú betartása, különös tekintettel a kezdeti szakaszra kezelés (a gyógyszer „titrálása”), és figyelembe véve annak mindegyikre felírt rendjét drog; - az epilepszia kezelése a gyógyszer kis adagjaival kezdődik, és fokozatosan növelje őket a rohamok teljes ellenőrzése érdekében; - a gyógyszer használatának gyakoriságát a felszabadulás formája és farmakokinetikai jellemzők. Nagy dózisok esetén az AED-nek kell írja be gyakrabban (legalább 3-szor), hogy elkerülje a negatívumot toxikus csúcskoncentráció okozta hatások. Ezek a következmények elkerülhetők a retardált formák használatával; - a kombinált terápia kerülendő, különösen a kezelés kezdetén, alatt a fokozott toxicitás és a kiszámíthatatlan gyógyszer elkerülése interakciók; - lehetetlen túl gyakran változtatni a gyógyszert és számos alkalommal gyógyszerek (különösen a barbiturátok és benzodiazepinek) hirtelen megvonása. A barbiturátok más AED-ekkel való helyettesítésének folyamata több hétig is eltarthat. és hónapokig, mivel a túl gyors lemondás provokálhat epilepsziás állapot; - a kezelést az egyes esetekben megállapított feltételek szerint kell elvégezni az epilepszia formái. A kezelés idő előtti abbahagyása visszaeséshez vezet epilepszia és a receptorok érzéketlensége az előző újbóli kinevezésével drogok; - a kezelés megkezdése előtt el kell ismertetni a beteggel a terápia alapelveit és A kezelési program kiválasztásakor vegye figyelembe a társadalmi és családi tényezőket (különösen jelentős a rezisztens formák kezelésében). A szülőket meg kell győzni magát a beteget, hogy változtatásokat hajtanak végre a kezelési rendben vagy a gyógyszerváltásban az optimális terápiás hatás szisztematikus keresése érdekében. |
Jelenleg körülbelül 30 görcsoldó szert szintetizáltak,
eltérő antikonvulzív hatásspektrummal. Oroszországban
a világ gyakorlatban használt alapvető AED-ek többségét használják (lásd.
asztal). A szakemberek azonban keveset ismerik az új AED-ket és a modern
Az epilepszia kezelésének alapelvei. A legtöbb esetben a találkozó
elavult AED-k, mint a fenobarbitál, benzonál, hexamidin, klorakon, trimetin,
valamint a további egyidejű alapok tömege, amelyek kölcsönhatása nem
tanulmányozzák, és a kompozíciókat empirikusan választják ki. Ezek az AED-k jelentősen gátolják
magasabb kérgi funkciók, és egyetlen előnyük az alacsony költség.
A kiadvány célja a neurológusok, pszichiáterek és
gyermekorvosok az epilepszia diagnosztizálásában és kezelésében, a gyermekek ellátásának javításában,
epilepsziás betegek. Ezen erőfeszítések végeredménye mindkettő csökkentése lehet
az alapbetegségből eredő személyes károk, valamint a gazdasági és társadalmi veszteségek
a társadalom számára a rossz miatt gyógyszeres kezelésÉs
pszichológiai és pedagógiai korrekció. Természetesen ezt világosan megértjük
az epilepszia kezelésének egyéninek kell lennie, hogy ne a betegséget kezeljék, hanem a beteget,
ezért ajánlásaink csak a megállapított hosszú távúra vonatkoznak
klinikai toborzási tapasztalat gyógyszereket a rohamok típusától a formákig
epilepszia. Az ilyen kezelés alapelveit Lennox neves epileptológusok dolgozták ki,
Janz, Doose és hazánkban P.M. Sarajishvili és V.A. Karlov.
Nem szabad megfeledkezni arról, hogy az epilepszia kezelésére használt összes gyógyszer, in
bizonyos mértékig erősen mérgező. Ezek befolyásolják a kognitív képességeket
a vérképző rendszer funkciói, a máj és a vese működésének megsértését okozhatják,
teratogén hatásokhoz vezetnek. Ezzel kapcsolatban az epilepszia kezelésének megkezdése,
az orvosnak figyelembe kell vennie, hogy az AED használatának veszélye nem lehet magasabb
az alapbetegség szövődményeinek kockázata. A betegeknek és hozzátartozóknak kell lenniük
-ról tájékoztatták lehetséges szövődmények AEP, meg kell adni
utasításokat a cselekvés taktikájára vonatkozóan, amikor megjelennek.
Az epilepszia rezisztens formáinak diagnosztizálása és kezelése gyermekeknél
Infantilis görcsök (IS)
Az IS diagnosztizálásának kritériumai:
- rohamok megjelenése az 1. életévben (maximum 4-9 hónap);
- a rohamok sajátos jellege rövid hajlítás formájában,
a nyak izomzatának feszítő vagy hajlító-extenzor összehúzódásai, törzs és
végtagok; - rohamok nagy gyakorisága a nap folyamán, sorozatosság;
- különböző mértékű késleltetett pszichomotoros fejlődés
kifejezőkészség; - A hypsarrhythmia specifikus EEG-mintája (hiperszinkronizált
ritmus, a nagy amplitúdójú lassú hullámok túlsúlya, periódusokkal keveredve
diffúz gyors ritmus vagy a görbe ellaposodásának epizódjai); - rezisztencia a fő alapvető görcsoldókkal szemben.
IS kezelés
A valproinsav-származékok az IS kezelésének alapvető gyógyszerei.
Az átlagos terápiás dózis napi 20-70 mg kg. Azonban a maximum
az általunk alkalmazott adagok napi 200 mg/kg volt. A természettől függően
rohamok (görcsök) a valproátok kiegészítő terápiájaként,
a következő gyógyszerek: benzodiazepinek, lamotrigin. szukcinimidek, karbamazepin.
Jelentős javulást (a rohamok 75-100%-os megállítása) értünk el
az esetek 78%-a.
Ezekkel a gyógyszerekkel szembeni abszolút rezisztencia esetén lehetséges
hormonterápia (ACTH, synachen-depot, kortikotropin, prednizon, dexazon
) görcsoldókkal kombinálva.
Lennox Gastaut szindróma
Az SLH diagnosztizálásának kritériumai(Lennox-Gastaut-Aicardi szerint):
- etiológiai heterogenitás;
- a görcsrohamok 17 éves korban jelentkeznek;
- epilepsziás rohamok polimorfizmusa egy betegben:
atipikus távolléti rohamok, myoklonusos rohamok (bólogatás, csipegés, megdöbbenés),
atonikus-asztatikus és tónusos-asztatikus rohamok, rövid tonik
görcsök, különösen alvás közben, klónos és tónusos-klónusos görcsök, ritkábban
részleges rohamok); - rohamok nagy gyakorisága a nap folyamán;
- a rohamok változékonysága naponként (jó és rossz napok);
- mentális retardáció és beszédfejlődés;
- EEG-mintázat-diffúz lassú csúcs-hullám aktivitás
kétoldali és szinkron 1-2,5 Hz frekvenciával, általában a frontális ill.
temporális lebenyek. Álom ( lassú fázis) élesen kóros aktivitást vált ki
típusú polyspike-wave 10 Hz frekvenciájú, jellemző a tónusos rohamokra.
SLH kezelése
Az alapkészítmények a valproesav származékai; közepes
a terápiás dózis 30-100 mg 1 testtömegkilogrammonként. Hatékony
A kombinációk bizonyos rohamok túlsúlyától függően a következők:
valproátok + szukcinimidek, valproátok + lamotrigin, valproátok + karbamazepin.
Generalizált klónikus (tónusos-klónusos) rohamok jelenlétében és
állapota rohamok lefolyása, származékai harmadik gyógyszerként írhatók fel
barbitursav. A kezelés hatékonysága 70%.
Az epilepszia idiopátiás formáinak diagnosztizálása és kezelése
Az epilepszia idiopátiás formái általában jóindulatúak
formák. Egyes esetekben azonban a rohamok rezisztensek az alapvető görcsoldó szerekkel szemben.
A terápiás hatékonyság hiányát olyan formákban hangsúlyozzák, mint pl
juvenilis hiány - epilepszia, epilepszia myoklonus hiányokkal, epilepszia vele
myoklonikusan asztatikus rohamok (az utolsó két formát gyakrabban nevezik
kriptogén generalizált epilepszia).
Gyermekkori távollét epilepszia (CEA)
A DAE diagnózisának kritériumai:
- debütálás 38 évesen;
- a lányok gyakrabban szenvednek;
- a tipikus komplex hiányos rohamok a rohamok fő típusai;
- a rohamok legmagasabb gyakorisága jellemzi: tíz és száz per
nap; - kapcsolat az esetek mintegy 30%-ában lehetséges
generalizált görcsös rohamok; - tipikus EEG mintázat generalizált csúcshullám aktivitás
3 Hz-es frekvenciával, ami különösen gyakran fordul elő hiperventillációval.
A DAE kezelésének alapelvei:
Alapvető gyógyszerek generalizált görcsrohamok hiányában
szukcinimidek és valproátok; generalizált görcsrohamok jelenlétében
kizárólag valproátok. Az átlagos terápiás dózisok a
szukcinimidek 10-15 mg/ttkg/nap 2 adagban, valproátok 30-50 mg/kg/nap
3 4 fogadás. Tartalék gyógyszerek benzodiazepinek és lamotrigin. Ellenállásban
esetek érvényesek a következő kombinációkat: valproátok + szukcinimidek; valproátok +
benzodiazepinek; lamotrigin valproátok. Teljes terápiás remisszió között
az általunk vizsgált betegek 70%-ában, a többiben sikerült elérni
a rohamok gyakoriságának kifejezett csökkenése.
Fiatalkori epilepszia (JAE)
A JAE diagnózisának kritériumai:
- rohamok megjelenése, 8 éves kortól és idősebb kortól (maximum 9 13
évek); - egyszerű tipikus hiányzások (rövidebbek és ritkábbak, mint vele
DAE) a rohamok fő típusa; - magas a generalizált görcsroham kockázata
rohamok 75%-ig; - az EEG-t általánosított csúcshullám megjelenése jellemzi
4 Hz vagy annál nagyobb frekvenciájú tevékenység.
A JAE kezelés elvei
Az alapkészítmények kizárólag a valproesav származékai. Közepes
A terápiás dózis napi 30-50 mg/kg, 3-4 adagban. Ellenálló esetekben
különösen gyakori generalizált görcsrohamok esetén lehetséges
kombinációk: valproát + barbiturátok, valproát + lamotrigin. teljes
terápiás remisszió ritkábban érhető el, mint DAE esetén, az esetek 56%-ában és
jelentős, 37%-os javulás. A prognózis romlik a gyakori kiegészítéssel
generalizált rohamok.
Epilepszia izolált generalizált görcsrohamokkal (GSE)
A HSP diagnózisának kritériumai:
- debütál egy nagyon széles korosztályban, 3 és 30 év között
átlag 13 17 év); - kizárólag tónusos-klónusos rohamokban nyilvánul meg
görcsrohamok, általában felébredéshez vagy elalváshoz; - a támadások gyakorisága alacsony, ritkán haladja meg a havi 1 alkalommal;
- idővel lehetőség van a hiányzások ill
myoklonusos rohamok az epilepszia abszansz formáivá átalakulással vagy
juvenilis myoclonus epilepszia.
A GSP kezelésének elvei
Az alap gyógyszer a karbamazepin. Az átlagos adag 15-25 mg/kg per
nap 3 adagban. Tartalék gyógyszerek valproátok, barbiturátok, hidantoinok. BAN BEN
rezisztens esetekben kombinációk lehetségesek: karbamazepin + valproát;
karbamazepin + barbiturátok; karbamazepin + hidantoinok: valproátok + barbiturátok;
barbiturátok + hidantoinok. Abszansok vagy myoklonus rohamok hozzáadásával
a karbamazepin azonnali cseréje valproáttal szükséges. Teljes remisszió 70%
esetek száma, és a rohamok számának jelentős, 27%-os csökkenése. Fiatalkori myoclonus
epilepszia (JME)
A JME diagnózisának kritériumai:
- debütálás 8 évesen és idősebben (átlagéletkor 13-18);
- obligát típusú rohamok, masszív myoklonus paroxizmusok,
általában a betegek felébresztése után jelentkezik, és alváshiány váltja ki; - a generalizált görcsrohamok 95%-ban csatlakoznak
esetek és hiányzások 30%-ban; - a fényérzékenység jelensége a betegek 30% -ánál figyelhető meg;
- az EEG-re általánosított gyors csúcs és
policsúcs-hullám aktivitás.
A kezelés elvei
Bázis gyógyszerek valproinsav származékai. Átlagos adag 30 50
mg/ttkg naponta 3 részre osztva. A rezisztens hiányrohamok esetén a kombináció
valproátok + szukcinimidek vagy valproátok + lamotrigin, és általánosított
görcsös valproátok + barbiturátok.
Súlyos fényérzékenység esetén valproát + klonazepam. Teljes remisszió 71%
esetek száma, a rohamok száma pedig 29%-kal csökkent.
Jóindulatú gyermekkori parciális epilepszia központi temporálissal
tüskék (idiopátiás rolandiás epilepszia) (RE)
A RE diagnózisának kritériumai:
- debütálás 2-12 évesen (maximum 5-9 évesen);
- a fiúk túlsúlya;
- jellemzően rövid arc-brachialis rohamok jelenléte, mely
paresztézia előzi meg a szájüregben, a garatban; - rohamok általában egyszerű részleges és
másodlagos generalizált görcsös; - túlnyomórészt éjszakai rohamok jellemzőek;
- a támadások gyakorisága ritkán haladja meg a havi 1 alkalommal;
- Az EEG-t a Rolandic csúcshullám megjelenése jellemzi
a főként központi és időbeli feladatokban felmerülő komplexusok; - az esetek túlnyomó többségében (96%) van egy teljes
a rohamok spontán remissziója 13 év után.
RE kezelési elvek
Az alap gyógyszer a karbamazepin. Az átlagos adag 10
20 mg / kg naponta 2 3 adagban. A tartalék gyógyszerek a hidantoinok,
valproátok. A politerápia nem megengedett! A betegek 97% -ánál teljes remisszió figyelhető meg.
A részleges (lokalizációhoz kötött) formák diagnosztikája és kezelése
epilepszia (tüneti vagy kriptogén)
Occcipitalis, parietális, frontális és temporális formák felosztása
lokalizációval összefüggő epilepszia. Az etiológiai tényezők változatosak (daganatok,
agysérülés, érrendszeri rendellenességek, születési trauma és fulladás, fejlődési rendellenességek
az agy fejlődése, neuroinfekciók következménye stb.), kezdeti életkor
változó. Részleges egyszerű és összetett rohamokban nyilvánul meg, valamint
másodlagos generalizált görcsös paroxizmusok. A tünetek attól függnek
az epileptogén fókusz lokalizációja. Az EEG regionálisat mutat
csúcshullám aktivitás. A neuroradiológiai vizsgálat feltárja
szerkezeti változások az agykéreg megfelelő területén (tüneti
forma) vagy ezek a változások nem jelennek meg (kriptogén forma).
A kezelés alapelvei:
Ha tünetek jelentkeznek, zárja ki a sebészeti kezelés szükségességét.
Az AED felírásának elvei nem függenek az epileptogén fókusz lokalizációjától. Alapvető
A gyógyszer a karbamazepin. Az átlagos adag 15-30 mg/kg per
nap 3 4 adagban. Tartalék gyógyszerek: hidantoinok, valproátok, barbiturátok,
lamotrigin. Politerápiával a felsorolt gyógyszerek bármely kombinációja lehetséges.
Egyszerű, másodlagos generalizációval járó részleges rohamokban előfordulhatnak
A karbamazepin és valproát kombinációja javasolt. A prognózis nagyban függ
az agykárosodás természetéről (az epilepszia etiológiai tényezője).
Asztal. Oroszországban használt AED
Adataink szerint a legtöbb gyakori okok elégtelen
terápiás hatás a következők:
- az epilepszia rohamtípusainak és formáinak téves osztályozása;
- az AED helytelen kiválasztása;
- az AEP elégtelen adagja;
- több AED helytelen kombinációja;
- túl gyakori gyógyszercsere;
- a gyógyszerek idő előtti visszavonása;
- durva morfológiai változások az agyban;
- a kezelés elveinek elégtelen magyarázata a páciens számára;
- a társadalmi és családi tényezők alulbecslése.
Az antikonvulzív szerek visszavonásának elvei
A görcsrohamok teljes hiánya után 2-4 év elteltével az AED-k adását le lehet állítani.
A klinikai kritérium (a rohamok hiánya) a fő kritérium a kezelés abbahagyásához
terápia. Az epilepszia jóindulatú formáival (DAE, RE), gyógyszerelvonás
2-2,5 év remisszió után végezhető. Az epilepszia súlyos formáiban (szindróma
Lennox-Gastaut, tüneti részleges epilepszia) ebben az időszakban
3 4 évre nő. A teljes terápiás remisszió elérésekor 4
évben a kezelést minden esetben abba kell hagyni. A kóros betegségek jelenléte
Az EEG-változások vagy a betegek pubertása nem tényező
a görcsoldók visszavonásának késleltetése rohamok hiányában több mint 4 évre. Nem
konszenzus van a görcsoldó elvonási taktikák kérdésében. Kezelés
tetszés szerint 13 hónap alatt, vagy egyszerre is megszüntethető
orvos.
Összegzésként meg kell jegyezni, hogy a bemutatott epilepszia kezelési program
bevezető terápiára tervezték, főleg kórházi környezetben. És ha be
a gyógyszer helyes megválasztása következtében a rohamok olyan körülmények között megszűntek
kórházba, ez nem jelenti a rohamok megszűnését a falakon kívül. Ezért
a betegek további monitorozását központilag kell elvégezni
speciális epileptológiai központok. A gyógyszeres terápia mellett
társadalmi alkalmazkodás, az oktatás, a munkaerő elnyerésének lehetősége
készségek. E cél elérése érdekében vannak olyan állami szervezetek, amelyek
hazánkban jött létre.
Egy fiatal férfi jött a recepcióra, hogy fogadjon epilepsziás szakember segítsége . Kétféle rohamtól szenved: pánik és epilepszia. A férfi mereven viselkedik, engedélyt kért, hogy leüljön az iroda túlsó sarkába, nem akarja megközelíteni az orvost.
Régen hosszú évekig polgári házasságban éltem. De a betegség kezdetétől számított 3 hónap elteltével távozott. Miért kell elrontani egy fiatal gyönyörű lány életét? Nagymamámhoz költözött.
Most már csak otthon tudok dolgozni, egyszeri megrendeléseket teljesítek, szabadúszóként dolgozom. De ez sokkal kevésbé hatékony számomra, mint korábban. nekem kettő van felsőoktatás Egy nagy cégnél dolgoztam.
A fő problémák most a következők a pánikom, depresszió és rossz memória.
Ugyanezek a rohamok 3 hónap múlva, majd 1, majd 2 hónap múlva jelentkeztek. A beteg minden alkalommal konzultált különböző szakemberekkel - neurológusokkal.
A terápia során a Finlepsin adagját az átlagos terápiás dózisra emelték, majd gyorsan megszüntették. Ezután azonnal adja be a lamotrigint alacsony dózisban. A gyógyszernek nem volt mellékhatása. A kórházban egyidejű terápiát végeztek: nootropikumok, B-vitaminok, érrendszeri, nyugtatók.
Jelenleg alacsony dózisú lamotrigint kap.
Az epilepsziás rohamok mellett fontosak a rossz egészségi panaszok:
Általános gyengeség, rossz közérzet, fokozott fáradtság.
Körülbelül 5 kg fogyás a folyó évben.
Fejfájás hetente 1-2 alkalommal, a frontális régióban vagy diffúz, nyomós, közepesen erős a nap bármely szakában.
A felmérés eredményei szerint
Által EEG alvásmegvonással
- mérsékelt diffúz változások az agy bioelektromos aktivitásában. A háttér-EEG-n és az alvási EEG-n epilepsziás aktivitást főként a fronto-parieto-anterotemporális elvezetésekben, inkább a bal oldalon észleltünk. 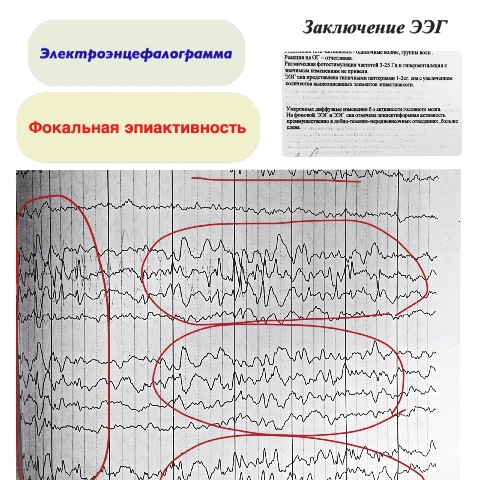
agyi MRI
- az agy fejlődési rendellenességei szubependimális szürkeállomány heterotópia
a bal oldali parietális régióban. A kamrák enyhe aszimmetriája. Retrocerebrális ciszta. A frontális és a parietális lebeny arachnoid tereinek kitágítása.
Elemzések - patológia nélkül.
A diagnózis: Tüneti fokális epilepszia, szenzoros-motoros rohamok másodlagos generalizációval. Anomália az agy fejlődésében (a szürkeállomány heterotópiája a bal oldali parietális régióban).
- Tehát a recepción egy beteg egy másik városból. A szükséges vizsgálatot elvégezték. Az MRI változásokat mutatott ki az agy veleszületett anomáliájának formájában, amikor a szürkeállomány olyan területe található, ahol nem szabad - a jobb oldali parietális régióban (heterotopia). A heterotópia helye leggyakrabban erősen epileptogén zóna. Ez azt jelenti, hogy a rohamok gyógyszerrezisztensek lehetnek.
Annak ellenére, hogy ez az anomália veleszületett, az epilepszia nem gyermekkorban jelentkezett, hanem 28 évesen.
A korábbi epilepszia elleni kezelés nem volt hatékony és biztonságos.Mi a teendő ebben az esetben az epilepsziával?
Epilepszia elleni gyógyszert váltani? Növelje a dózist a maximálisan tolerálható értékre, elérve a ? Visszatérni a régi gyógyszerekhez, amelyek a titrálási szabályok megsértése miatt nem hatékonyak? Adjunk hozzá egy második antiepileptikumot? Vezessünk be egy gyógyszert az új gyógyszerek csoportjából? Idegsebészhez fordulni?
Figyelembe kell venni azt is, hogy a betegnél komorbid állapot alakult ki: depresszió, pánikrohamok, sőt mérsékelt memóriazavarok is előfordultak.
Társadalmi helyzete drámaian megváltozott.
Mindezeket a problémákat átfogóan kell kezelni. És ezeknek a problémáknak a többsége sikeresen megoldható.
2 év alatt mindössze öt epilepsziás roham volt, de napi pánikhelyzetek, legyengítő, mérgező élet.
Mik azok a pánikrohamok?
A pánikrohamok (pánikrohamok) az intenzív szorongás hirtelen fellépő epizódjai.
- A pánikrohamokat úgy írják le : „Rossz lesz a szobában, van szédülés, gombóc a torokban, légszomj, hányinger, hasi fájdalom, ritkábban hasmenés, szapora szívverés érzése, bizsergés a kéz- és lábujjakban, homályos látás, gyenge reakció másoknak. Félelem a támadástól és az eleséstől, hogy a támadás nyilvánosan megtörténik. Félelem a haláltól, félelem attól, hogy megőrül.
- Az ilyen pánikrohamok néhány perctől egy óráig tartanak (átlagosan 20 perc); naponta vagy heti 2-4 alkalommal; napi 1-10 vagy több alkalommal; gyakoribbá válnak otthonon kívül, zsúfolt szobában; élesen vagy fokozatosan halad át, semmi sem segít eltávolítani egy ilyen támadást, amíg az magától el nem múlik. A rohamok súlyossága nagyon eltérő lehet: lehetnek enyhék, mások számára észrevehetetlenek, és sürgősségi ellátást igényelnek.
Gyakran felmerül a kérdés, veszélyes lehet-e a pánikroham?
A pánikroham szenvedést okoz, nagymértékben befolyásolja az életet, felborítja, megbénítja az akaratot, de nem életveszélyes. A pánikrohamok nem okozhatnak halált.
pánikrohamok gyakran ahhoz a tényhez vezet, hogy az emberek ezeken a támadásokon kívül szoronganak. A félelem olyan helyzetekben is felmerül, amelyeket korábban jól toleráltak. Az emberek bezárulnak. Feladják régi szokásaikat, terveiket, kommunikációjukat, utazásaikat. A pánikrohamok következményei a szakmai és a családi életben is megmutatkoznak.
Az epilepsziás beteg pánikrohamainak jelenléte terápia kijelölését igényli.
Pánikrohamok kezelése
Pánikrohamok kezelésére használják pszichotróp szerek. A kezelés sikerét a gyógyszer egyéni megválasztása és adagolása határozza meg.
Pszichotróp szerek
A mai napig több száz pszichotróp gyógyszer ismert. A hatásmechanizmus szerint feltételesen csoportokra oszthatók: antipszichotikumok, nyugtatók, antidepresszánsok, hangulatstabilizátorok, altatók, nootróp szerek, pszichostimulánsok. A legtöbb gyógyszer több csoportba sorolható.
A pánikrohamokat általában három csoporttal kezelik: neuroleptikumok, nyugtatók, antidepresszánsok.
nyugtatók
A nyugtatók hatása nyugtató, hipnotikus, izomlazító, görcsoldó, szorongásoldó.
Elnyomja a szorongást, a feszültséget, a szorongást; pihenni; fokozza az antiepileptikumok hatását. Csökkentse a pánikrohamok valószínűségét és súlyosságát. Legfeljebb 2 hónapig alkalmazza, hogy ne károsítsa a figyelmet és a memóriát.
A nyugtatók osztályozása generációnként
Ebbe a csoportba három gyógyszergeneráció tartozik:
1. Első generációs nyugtatók: Meprobamate; hidroxizin; Benaktizin.
2. A második generációs nyugtatók - a benzodiazepin-sorozat gyógyszerei.
3. A harmadik generációs nyugtatók: Buspirone; hidroxi-metil-etil-piridin-szukcinát; Etifoxin.
- Széles körben használt gyógyszerek a második generációból. A benzodiazepinek domináns klinikai hatásuk szerint 3 csoportra oszthatók:
2.2.1. 1 Kifejezett szorongásoldó hatású benzodiazepinek: Phenazepam, Diazepam, Lorazepam, Alprazolam.
2.2.1.2. Mérsékelten kifejezett szorongásoldó hatással: Gidazepam, Chlordiazepoxide, Bromazepam, Clobazam, Oxazepam.
2.2. 2. A benzodiazepinek kifejezett hipnotikus hatás(altatóként használjuk): Temazepam, Triazolam, Nitrazepam, Flurazepam, Flunitrazepam, Midazolam, Esztazolam.
2.3. Kifejezett görcsoldó hatással rendelkező benzodiazepinek: Clonazepam, Diazepam.
Az új generációs nyugtatók:
3.1. Buspiron (nincs nyugtató hatása, negatív hatással van a pszichomotoros funkciókra, nem okoz függőséget, gyógyszerfüggőséget és elvonási tüneteket).
3.2. Etifoxin (szelektív hatás).
Nappali nyugtatók listája(domináns szorongásoldó és minimális nyugtató, hipnotikus és izomlazító hatással): Trioxazin, Tofisopam, Gidazepam, Prazepam, Mebicar, Trimetozin, Phenibut.
2. Antidepresszánsok
A leghatékonyabb a pánikrohamok kezelésében. A depresszió és a pánikrohamok kombinációja rendkívül hatékonynak bizonyult. A depresszió tüneteinek hiányában is alkalmazzák.
Az antidepresszánsokat széles körben használják: Anafranil, Paxil, Sertralin, Cipralex, Duloxetine (Cymbalta), Imilnacipran (Ixel).
Pszichiáter felügyelete mellett a gyógyszer dózisának egyéni megválasztása szükséges, figyelembe véve a hatékonyságot és a tolerálhatóságot.
Az antidepresszánsok szedésének mellékhatásainak súlyossága és azok lemondása bármely fórumon olvasható.
Epilepszia- az agy krónikus betegsége, amely ismétlődő, provokálatlan rohamokban nyilvánul meg, károsodott motoros, szenzoros, autonóm, kognitív, mentális funkciókkal, amelyet az agykéreg szürkeállományának túlzott mértékű neuron-kisülései okoznak.
A bemutatott definíció két fontos rendelkezést tartalmaz: 1) csak ismétlődő rohamok képezik az epilepszia diagnózisának alapját; 2) az epilepszia magában foglalja a spontán, provokálatlan rohamokat (kivéve a reflexes formákat, például a fényérzékenységi epilepsziát). A lázgörcs nem minősül epilepsziának, csakúgy, mint az akut agyi betegségekben fellépő görcsök (például agyvelőgyulladás, szubdurális hematóma, akut cerebrovascularis baleset stb.).
A betegséggel kapcsolatos modern elképzelések csak akkor kezdtek formát ölteni késő XIX V. J. Jackson 1888-ban úgy határozta meg az epilepsziát, mint "...az agy szürkeállományának véletlenszerű, hirtelen és túlzott helyi zavara"; "uncus rohamokat" (szagló hallucinációk halántéklebeny epilepsziában) és "álomállapotokat" (mentális funkciókkárosodott rohamok) írt le. ÉS ÉN. Kozhevnikov (1898) az epilepszia minden formáját "szerves" (a modern terminológia szerint - tüneti) és alkotmányos (idiopátiás) csoportokra osztotta. Az első kísérletet az epilepsziás rohamok osztályozására W. Gowers angol neurológus tette 1903-ban. Az epilepszia diagnózisának szindrómológiai megközelítését W. Lennox 1961-ben, H. Gasteau 1966-ban és G. Doose 1980-ban dolgozta ki. hozzájárultak az epilepszia vizsgálatához hazai tudósok, P.M. Sarajishvili és V.A. Karlov.
A XX. század végén. az epilepszia gyógyítható betegséggé vált. Az epilepsziás szindrómák modern osztályozása 1989-ben kimondja, hogy az epilepsziának (szindrómának) számos formája van, amelyek saját lefolyási mintázattal és fejlődési prognózissal rendelkeznek, attól függően, hogy milyen elektromos kisülések lépnek fel az agykéregben, hol lokalizálódnak, hogyan terjednek, átalakul, és milyen rohamok lépnek fel egyidejűleg a betegben. Az epilepszia vizsgálatában fontos szerepet játszanak a neuroimaging technikák (CT, nagyfelbontású MRI, PET, SPECT), a digitális EEG és a video-EEG monitorozás. Jelenleg az epilepsziás esetek körülbelül 65%-a teljesen gyógyítható; az esetek 20%-ában ezt sebészi módszerekkel érik el.
Megváltozott a betegekhez való viszonyulás is, javult a szociális alkalmazkodásuk. Mindeddig azonban e súlyos betegség patogenezisének számos mechanizmusát nem vizsgálták; létezik nagyszámú atipikus formák, amelyek jelentősen megnehezítik a pontos diagnózist; Az epilepszia egyes rezisztens formái még mindig kezeletlenek.
Az epilepszia prevalenciája a lakosság körében eléri a 0,5-0,75% -ot, a gyermekeknél pedig az 1% -ot. A betegek 75%-ánál az epilepszia gyermek- és serdülőkorban debütál, az egyik leggyakoribb kóros állapotok gyermek neurológia.
Az epilepszia minden formája etiológiája szerint idiopátiás, tüneti és kriptogén jellegű.
Mert idiopátiás formák normál intelligencia, fokális tünetek hiánya és az agy szerkezeti elváltozásai a betegben, valamint örökletes hajlam (epilepsziás esetek rokonoknál). Az etiológia főként a csatornapathiának köszönhető - a neuronális membránok genetikailag meghatározott diffúz instabilitásának. Az epilepszia három fő, monogénen öröklődő formájának génjeit azonosították: autoszomális domináns frontális epilepszia éjszakai rohamokkal (20ql3.2 és 15q24 lókusz), jóindulatú családi újszülöttkori rohamok (20ql3.2 lókusz és 8q24 lázgörcsök) és plusz epilepsziás görcsök. (19ql 3.1 lókusz, az SCN1B gén mutációja; 2q21-q33, az SCN1A gén mutációja). A többi formát több gén határozza meg (poligén öröklődés). Ide tartozik a juvenilis myoclonus epilepszia, a rolandikus epilepszia, a csecsemőkori parciális (családi) jóindulatú epilepszia stb. Gyakorlati szempontból nem szabad megfeledkezni arról, hogy ha az egyik szülő idiopátiás epilepsziás, akkor a beteg gyermek születésének valószínűsége legfeljebb 10%.
Tüneti formák Az epilepsziákat a morfológiai szubsztrát kötelező jelenléte jellemzi: daganatok, ciszták, gliahegek, agyi anomáliák és aneurizmák. Ezeket neuroimaging technikákkal észlelik.
Term "kriptogén" ("feltehetően tüneti eredetű") az epilepsziának azokat a formáit határozza meg, amelyek okát minden korszerű vizsgálati módszer alkalmazásával sem tisztázzák. Például epilepszia és hemiparesis vagy veleszületett mentális retardáció kombinációja esetén feltételezik a betegség tüneti jellegét, de a CT vagy MRI vizsgálatok nem mutatnak ki agyi elváltozásokat.
Fokális A rohamokat és az epilepszia formáit a kortikális „epileptogén fókusz” fogalma magyarázza, amely a „pacemaker” szerepét tölti be. A benne fellépő hiperszinkron kisülés nagyszámú kérgi idegsejteket érint, amelyek átterjednek az agy szomszédos területeire.
Nál nél általánosított Az epilepszia formái, a rohamok kezdettől fogva generalizálódnak, amit az EEG adatok is megerősítenek (kétoldali szinkron terjedés mindkét féltekére). Az epilepszia generalizált formáinak patogenezise még mindig nem elég világos. A vezető thalamo-kortikális hipotézis az elsődleges generalizáció kialakulását az agykéregből és a thalamusból álló integratív rendszerrel magyarázza (thalamo-corticalis és cortico-thalamus útvonalak). A kisülések forrása feltehetően az agykéregben található, a thalamo-kortikális kapcsolatok szinkronizálják a generalizált csúcshullám-kisüléseket, az agytörzs (elsősorban a középagy) retikuláris formációja pedig modulálja a kéreg kisülésekkel szembeni "túlérzékenységének" szintjét. A gyrus cingulate, az orbitofrontalis cortex, az amygdala-hippocampus komplexum és a substantia nigra is részt vesz az epilepsziás váladék eloszlásában és generalizációjában. A thalamo-kortikális rendszer stimulálásakor generalizált csúcshullám-aktivitás léphet fel az EEG-n, valamint ritmikus delta hullámok kétoldali szinkron paroxizmális kisülései.
Az elsődlegesen generalizált epilepszia a thalamo-kortikális rendszer abnormálisan magas ingerlékenysége esetén fordul elő. Az ingerlékenység mértéke valószínűleg genetikailag meghatározott, és az idegsejtek membránjainak instabilitásából és a Na-, K- és Cl-ionok normál gradiensének fenntartására való képtelenségből adódik.
Az epilepsziás rohamok osztályozása A Nemzetközi Epilepszia Elleni Liga 1981-ben fogadta el Kiotóban (Japán). Az epilepsziás rohamok a következőkre oszthatók: 1) fokális (fokális, fokális, lokális, lokálisan kondicionált); 2) általánosított; 3) nem minősített (20. táblázat).
Fokális (fokális, fokális) rohamok akkor diagnosztizálják, ha a paroxizmus kezdetén egyértelmű klinikai és elektrofiziológiai kritériumok vannak bizonyos agyi struktúrák érintettségére. Például az egyik oldalon az arc és a kar felének klónos görcsök (faciobrachialis rohamok) esetén az epilepsziás fókusz az elülső középső alsó részein található.
központi gyrus; szagló hallucinációkkal - a temporális gyrus horog régiójában; fotopsiával - az occipitalis lebeny kéregében; "gondolati kudarcokkal" (dysmnéziás rohamok) - a homloklebenyben stb. Egyszerű részleges rohamok esetén a tudat nem zavart. A roham során az EEG-n helyi epilepsziás váladékozás figyelhető meg, az agykéreg megfelelő területétől kezdve.
Fokális támadás másodlagos általánosítással Kezdődhet részlegesen, de aztán általánossá válik, amely a törzs és a végtag összes izmát érinti, és az epileptiform aktivitás átterjed az EEG-n mindkét féltekére.
Komplex gócos rohamok tudatzavarral fordulnak elő (támadás során a beteg nem reagál a megszólított beszédre, nem követi a parancsot, amnéziálja a támadást). Az EEG komplex parciális roham során egy- vagy kétoldali epilepsziás váladékot mutat, gyakrabban a temporális vagy frontális elvezetésekben (21. táblázat).
NAK NEK generalizált rohamok ide tartoznak a tipikus és atipikus hiányok, a klónos, tónusos, klónikus-tónusos és atóniás rohamok, valamint a myoclonus.
20. táblázatAz epilepsziás rohamok nemzetközi osztályozása (Kiotó, 1981)

Megállapítást nyert, hogy az epilepszia nem egyetlen betegség, amely különböző rohamokkal jár, hanem külön formákra oszlik -
epilepsziás szindrómák. A klinikai, elektromos és anatómiai kritériumok stabil kapcsolata jellemzi őket; eltérőek az antiepileptikus terápiára adott válaszban és a prognózisban (21. táblázat).
21. táblázatAz EEG megváltozik különböző rohamokkal
22. táblázat.Az epilepszia, epilepsziás szindrómák nemzetközi osztályozása (New Delhi, 1989)
1. Az epilepszia lokalizált formái (fokális, lokális, fokális)
1.1. Idiopátiás (életkorral összefüggő kezdetű)
Jóindulatú gyermekkori epilepszia központi temporális csúcsokkal (Rolandic).
Gyermekkori epilepszia occipitalis paroxizmákkal.
Elsődleges olvasási epilepszia.
1.2. Szimptomatikus
Krónikus progresszív részleges epilepszia (Kozhevnikov-szindróma).
Sajátos provokációs módszerekkel jellemezhető rohamok.
Az epilepszia egyéb formái ismert etiológiával vagy szervi elváltozásokkal az agyban.
1.3. Kriptogén



Meg kell jegyezni, hogy 1989 óta nyilvánvalóvá vált az osztályozás tökéletlensége, mivel egyes formák (például a pszeudo-Lennox-szindróma) nem szerepeltek benne. Ezenkívül a West-szindróma és a Lennox-Gastaut-szindróma számos tüneti formája nem tartozik a generalizált epilepsziához, mivel ezek részleges epilepsziák a másodlagos kétoldali szinkronizáció jelenségével. 2001-ben a Nemzetközi Osztályozási és Terminológiai Bizottság kiadta az epilepsziás rohamok és epilepsziás szindrómák új osztályozásának tervezetét (22. táblázat). A klasszikus fokális és generalizált rohamokra való felosztás mellett kimondja, hogy számos jóindulatú és önkorlátozó epilepsziás szindróma esetében az "epilepszia" kifejezést a "rohamok" kifejezéssel kell helyettesíteni. Például nem „alkoholos epilepszia”, hanem „alkoholelvonással járó rohamok” stb. Az epilepszia számos új formáját jól bejáratottan írják le, új kifejezéseket vezetnek be. A "részleges rohamok és részleges epilepsziák" kifejezést a "gócos rohamok és az epilepszia fokális formái" váltotta fel; "kriptogén formák" a "valószínűleg tüneti formák". A szindrómák definíciójában javasolt a „görcsök” szót „rohamokkal” helyettesíteni. A "rohamok" fogalma sokkal tágabb, mint a "görcsök", és nem minden roham nyilvánul meg pontosan a görcsökben. Megszűnt a fokális rohamok tudatzavartól függő egyszerű és összetett felosztása, mivel a legtöbb esetben a tudati szint megítélése irányadó marad. Az osztályozás előnye a gyermekkori epilepsziás encephalopathiák fogalmának kidolgozása.
DiagnosztikaAz epilepszia a következő algoritmust tartalmazza:
1. A paroxizmális esemény leírása (csak az anamnézis alapján lehetséges).
2. A rohamok osztályozása (előzmény, klinika, EEG, videó EEG monitorozás).
3. A forma diagnosztikája (anamnézis, klinika, EEG, videó EEG monitorozás, neuroimaging).
4. Az etiológia megállapítása (MRI, kariotipizálás, biokémiai vizsgálatok, izombiopszia stb.).
5. A kísérő betegségek diagnosztizálása és a rokkantság mértékének meghatározása.
Az epilepszia diagnózisa klinikai-elektroanatómiai. A 21. században az epilepszia pontos diagnózisának felállításához nem elég a hozzátartozók által adott rohamleírás. Elektroencefalográfiás igazolás (elektromos kritérium) és neuroimaging (anatómiai kritérium) szükséges. Mert pontos meghatározás a diagnózis felállítása és a helyes terápia előírása, a rutinmódszerek mellett szükséges a hosszú távú EEG videomonitorozás, éjszakai EEG monitorozás, nagy felbontású MRI 3D képalkotó módban stb.
14.1. Idiopátiás fokális formák
Jóindulatú részleges gyermekkori epilepszia központi időbeli csúcsokkal (rolandi epilepszia) [RE] - rövid pharyngooralis és hemifacialis motoros rohamok jellemzik, amelyek általában ébredés és elalvás után jelentkeznek, valamint tipikus változások az EEG-ben (14.1. ábra). A RE a gyermekkori epilepszia leggyakoribb formája. Az előfordulási arány 21/100 000 gyermekpopuláció.
A betegség 2-14 éves korban kezdődik (legfeljebb 7-9 éves korban), a fiúk gyakrabban betegek. Egyszerű gócos rohamok jellemzik, amelyek az esetek 80%-ában ébredés vagy elalvás után jelentkeznek. A roham szomatoszenzoros aurával kezdődik: bizsergés, zsibbadás az egyik oldalon a garat, a nyelv és az íny területén. Ezután a betegek sajátos torokhangokat adnak ki, mint például "gurgulázó", "görcsögő", "gargarizáló"; fokozott nyálfolyás és anarthria (pharyngooralis rohamok) figyelhető meg. Jellemzőek a mimikai izmok görcsei: egyoldali tónusos, klónos

Rizs. 14.1.Egy 4 éves Rolandi epilepsziás gyermek EEG-je
vagy az arc, az ajkak, valamint a nyelv, a garat, a gége izomzatának tónusos-klónusos görcsrohamai (félfaciális rohamok). A betegek 20%-ánál a rohamok az arc izmaiból a homolateralis karba terjednek (brachiofaciális rohamok); az esetek mintegy 8%-ában a lábban is megjelennek (egyoldali rohamok). A betegség előrehaladtával a rohamok iránya változhat.
Másodlagos generalizált görcsrohamok a gyermekek 25%-ánál fordulnak elő. A RE-ben a támadások néhány másodperctől 1-2 percig tartanak. Gyakoriságuk átlagosan évi 2-6 alkalom. Idővel egyre ritkábban fordulnak elő (még kezelés nélkül is), és felnőtteknél nem figyelhetők meg.
Az esetek 90%-ában az interiktális periódus EEG-változásait határozzák meg, jellemző mintázat az akut-lassú hullám komplexum. A kezdeti komponens általában egy háromfázisú éles hullámból áll, amelyet egy lassú hullám követ, amely komplexekre hasonlít QRST az EKG-n. Ez a tevékenység a centrális-temporális vezetékekben lokalizálódik, és "rolandinak" nevezik, vagy általános neve - "jóindulatú gyermekkori epileptiform rendellenességek" (BEND). Az RE diagnózisának megerősítéséhez fontos
EEG alvás közben - éjszakai EEG monitorozás, mivel a RE-ben szenvedő gyermekek körülbelül 30% -ánál a roland komplexeket kizárólag alvás közben észlelik.
Terápia.Figyelembe véve a jóindulatú lefolyást, lehetséges, hogy nem írnak elő antiepileptikumot. Nem kizárt azonban a diagnosztikai hiba, valamint a RE pszeudo-Lennox szindrómává való átalakulásának lehetősége az esetek mintegy 5%-ában 7 év alatti gyermekeknél. A terápiát ajánlott ismételt rohamokkal kezdeni. A kezelést mindig egy gyógyszerrel végzik (a politerápia elfogadhatatlan), kezdve a valproinsav származékokkal (depakin, convulex, convulsofin). A valproátokat fokozatos dózisemeléssel napi 15-30 mg / kg-ig (átlagosan 600-1500 mg / nap) 2 részre osztva írják fel.
A valproát hatástalansága vagy intoleranciája esetén a topiramátot (Topamax) 50-150 mg / nap (3-5 mg / kg) dózisban írják fel. Szintén a karbamazepin-csoport gyógyszereit (tegretol, finlepsin) használják középen napi adag 15-20 mg/kg (300-600 mg/nap). Egyes esetekben a karbamazepin az EEG-n a DEND index növekedéséhez és a rohamok számának növekedéséhez vezethet - ez a súlyosbodás jelensége. E tekintetben nem javasolt a karbamazepin felírása kezdeti terápiaként, valamint minden esetben 7 év alatti gyermekeknél. Barbiturátok és hidantoinok használata ellenjavallt!
EEG-ellenőrzés szükséges, beleértve az alvás EEG-ellenőrzését is. A remisszió az esetek 100%-ában 16 éves korig érhető el.
Idiopátiás részleges epilepszia occipitalis rohamokkal (jóindulatú occipitalis epilepszia, DZE)- látáskárosodással járó rohamok, migrénszerű tünetek és DEND mintázat jelenléte az occipitalis régióban az EEG-n. A DZE a gyermekkori epilepszia összes idiopátiás részleges formájának körülbelül 20%-át teszi ki. A DZE két változatát különböztették meg: a betegség korai és késői manifesztációjával.
Korai megjelenésű jóindulatú occipitalis epilepszia (Panayotopoulos szindróma) 1 és 13 éves kor között kezdődik, csúcspontja 3-6 éves korban jelentkezik. A betegség ritka, súlyos vegetatív rendellenességekkel járó rohamokban, hosszan tartó eszméletvesztésben és állapotváltozásra való hajlamban nyilvánul meg. A támadások alvás közben jelentkeznek, különösen ébredés előtt; hányással, fejfájással, az arc elfehéredésével kezdődik, majd a fej és a szemek oldalra fordítása következik. A rohamok általában hemikonvulzív vagy generalizált görcsökkel végződnek. Vannak "iktális szinkopációk", amelyek hosszú
eszméletvesztés és az izomtónus éles csökkenése, amely 30 perctől 7 óráig tart, átlagosan 2 óra A legtöbb beteg az intenzív osztályon végzi. Az "iktális syncope" vagy megelőzheti a másodlagos generalizált tónusos-klónusos görcsöket, vagy azoktól elkülönítve fordulhat elő. A súlyos állapot ellenére az ilyen támadások gyakorisága alacsony. Egyes esetekben csak egy roham van a betegség teljes időszakában. A prognózis abszolút kedvező.
Késői kezdetű jóindulatú occipitalis epilepszia (Gastaut forma) 3 és 15 éves kor között debütál, átlagosan 8 évesen. Egyszerű fokális érzékszervi rohamok jellemzik látászavarokkal, egyszerű vizuális hallucinációk formájában (kis, többszínű kör alakú alakok), amelyek gyakran a perifériás látómezőben fordulnak elő, és a fókusz ellentétes irányba mozognak. A támadások néhány másodperctől 1-3 percig tartanak. A látómezők ugyanazon felében hallucinációk fordulhatnak elő. Gyakran megfigyelhető egy változatos komponens: a szem és a fej ép tudattal ellentétes oldalra fordítása a fókusz felé. A rohamok egyoldalú vagy másodlagos generalizált tónusos-klónusos rohamokat eredményezhetnek. A betegek felénél egy rohamot követően intenzív lüktető, migrénszerű fejfájás lép fel, melyet hányinger és hányás kísér. A rohamok gyakorisága általában alacsony, bár egyes esetekben hetente is előfordulhatnak. Az EEG nagy amplitúdójú éles-lassú hullámú komplexeket tár fel, amelyek a betegek 2/3-ánál csak az occipitalis vezetékekben fordulnak elő. A komplexek morfológiája hasonló a gyermekkori jóindulatú epileptiform rendellenességekhez. A betegek 1/3-ánál epileptiform aktivitás más területeken is rögzíthető (gyakrabban a centrális temporális elvezetésekben).
Terápia.A DZE kezelésében elsőként választandó gyógyszerek a valproinsav sói (depakin, convulex, convulsofin), átlagosan 30-40 mg/kg napi dózisban. A gyógyszert két adagban írják fel, a maximális adagot este.
Nem megfelelő hatékonyság esetén lehetséges a monoterápia karbamazepin-készítményekkel (finlepsin, tegretol) átlagosan 15-20 mg / kg / nap vagy topiramáttal 75-200 mg / nap (3-6 mg / kg / nap) adagban. .
A Panayotopoulos-szindrómában a rohamok 9 év alatti teljes remissziója a betegek 92% -ánál fordul elő. A Gastaut formájú betegeknél az esetek 82%-ában 15 éves korig, 100%-ban 18 éves korig remisszió figyelhető meg.
Autoszomális domináns homloklebeny epilepszia éjszakai rohamokkal
egy idiopátiás forma. Két génlókuszt azonosítottak, amelyek felelősek a betegség kialakulásáért: 20q13.2és 15q, de szórványos esetek is előfordulnak. A debütálás kora 2 hónap és 52 év között változik, a maximum az élet első évtizedében. A betegek 70%-ánál a rohamok nem specifikus aurával kezdődnek: "hideg-szerű remegés", fejfájás, hallási hallucinációk, szédülés, szomatoszenzoros érzések (viszketés a törzsben), amely után a hipermotoros automatizmusokkal járó rohamok jellemzőek. Görcsös légzéssel, hörgéssel, üvöltözéshez hasonló erős kiáltással kezdődnek. Tágra nyílt szemek, rémült arc. A beteg felemeli a fejét, felül az ágyban; hipermotoros és disztóniás jelenségek jelennek meg. Néha a páciens (általában egy felnőtt) kaotikus mozdulatokat végez a karjával (például bokszoló mozdulatokkal) és a lábával (például a pedálozással); négykézlábra áll, és lengő mozdulatokat végez a medencével. A támadások során a tudat általában nem zavart. A rohamok kizárólag alvás közbeni előfordulása jellemző, ezek sorozatos formában többször is megismétlődhetnek az éjszaka folyamán, majd több napos vagy hetes szünet következik, és a sorozat újra folytatódik. A támadások időtartama - néhány másodperctől 1 percig. Ritka esetekben másodlagos generalizált paroxizmusok megjelenése lehetséges.
Az ébrenléti EEG nem specifikus. Diagnosztikailag jelentősek az éjszakai alvás EEG monitorozása és a video-EEG monitorozás adatai, amelyek kis amplitúdójú epileptiform aktivitást tárnak fel akut-lassú hullám komplex formájában, amely regionálisan az egyik frontális, frontotemporális elvezetésben vagy bifrontálisan aszinkron módon jelentkezik.
A kezdeti kezelés karbamazepin-készítményekkel kezdődik, legfeljebb kétszer lefekvés előtt. A napi adag 600-1000 mg / nap (15-30 mg / kg / nap). Ha hatástalan, a topiramátot 100-400 mg/nap (3-10 mg/ttkg/nap) dózisban írják fel, kétszer, legfeljebb lefekvés előtt. A kezelés következő szakasza a valproát monoterápia. A Convulexet kétszer írják fel egy adagban
900-1800 mg/nap (20-40 mg/kg/nap).
Ritka rezisztencia esetén politerápia alkalmazható, amely két alapvető AED kombinációjából áll (valproinsav karbamazepinnel vagy topiramáttal). A legtöbb esetben orvosi remisszió érhető el.
14.2. Az epilepszia tüneti fokális formái
Tünetekkel járó frontális epilepszia (SLE) egy lokálisan kondicionált forma, amely igazolt morfológiai rendellenességekkel rendelkezik az agy frontális lebenyeiben. Az epilepszia tüneti fokális formáinak 30-40%-át teszi ki, gyakoriságilag a második helyen áll a temporális lebeny epilepszia után (gyermekkorban előfordulási gyakoriságát tekintve megelőzheti a temporális lebeny epilepsziát).
Az etiológia magában foglalja a traumás agysérülést, a homloklebeny daganatait és cisztáit, a fokális kérgi diszpláziát, a perinatális encephalopathia következményeként fellépő gliózist és az érrendszeri anomáliákat.
Az SLE keretein belül több formát különböztetnek meg.
Motor (előmotor, Jackson) SLE akkor fordul elő, ha az elülső központi gyrus irritált. Egyszerű fokális motoros rohamok jellemzik, görcsökkel a fókusz ellenoldali végtagjaiban. A "jacksoni" menet a kéz- vagy lábgörcsökkel kezdődik, az azonos oldali kar-, láb- és arcizmok fokozatos bevonásával. A roham gyakran Todd átmeneti parézisével ér véget.
Opercular SLE akkor fordul elő, ha a homloklebeny opercularis zónája irritált. Komplex fokális (dialeptikus) rohamok jellemzik, száj-amentáris automatizmusokkal; az arcizmok esetleges azonos oldali rángatózása, vegetatív jelenségek.
Orbitofrontális SLE akkor fordul elő, ha a gyrus inferior frontális orbitális kérge irritált. Összetett fokális, vegetatív-zsigeri rohamok, heves vokalizációval járó paroxizmusok, atipikus hiányzások jellemzik.
Dorsolaterális (prefrontális) SLE a felső és alsó frontális gyrus hátsó szakaszából ered. Tonizáló ellentétes rohamokban nyilvánul meg, amikor a szem és a fej a fókusztal ellentétes irányba fordul; elrabolható és felemelhető a kéz, amelyre a páciens tekintete szegeződik. Gyakran a motoros afázia megjelenése a fókusz lokalizációjában a domináns féltekén.
Frontopoláris SLE akkor fordul elő, ha az epileptogén fókusz a homloklebenyek pólusának régiójában helyezkedik el. Egyszerű részleges rohamok, károsodott kognitív funkciókkal (gondolatok beáramlása, gondolatok „kudarca”, időbeli változás) és összetett részleges (dialeptikus) rohamok jelentik.
Cingular SLEa gyrus cingulate elülső részének irritációjával figyelhető meg. Komplex részleges rohamokként nyilvánul meg gesztus automatizmusokkal, azonos oldali villogó mozgásokkal, valamint "limbikus paroxizmusokkal": a félelem kifejezése, az arc kipirosodása, az érzelmi szféra megsértése - dysphoria.
A kiegészítő motoros területről származó SLE (motor előtti SLE), - a frontális epilepszia egyik leggyakoribb formája, amelyet rövid testtartási aszimmetrikus tónusos rohamok (görcsök) jellemeznek, amelyek kétoldalúan jelennek meg a proximális végtagokban (például a „kardforgató testtartás” típusa). A támadások túlnyomórészt éjszakaiak, sorozatosan fordulnak elő. Vannak olyan támadások is, amelyekben a beszéd tiszta elmével megáll, vagy sikolyok, üvöltő hangok formájában szólal meg. Sztereotip hipermotoros automatizmusokkal járó támadások lehetségesek: a karok (például boksz), a lábak (pedálos mozgások) és a medence kaotikus mozgása.
A rohamok rövidek, rövid vagy nem teljes eszméletvesztéssel, minimális postictal zavartsággal, sorozatos cikloleptikus lefolyásúak, és túlnyomórészt éjszaka fordulnak elő.
A neurológiai vizsgálat eredménye az SLE etiológiájától függ. Az elülső lebeny kiterjedt elváltozása esetén (például térfogati képződés) a hemiparézis a fókusztal ellentétes oldalon észlelhető (magas reflexek, patológiás reflexek); lehetséges hemiataxia. Gyakran viselkedési zavarok alakulnak ki a "frontális psziché" típusának megfelelően.
Az interiktális időszakban az EEG nem informatív vagy nem specifikus. Előnyös a hosszú távú (és mindig alvás közbeni) EEG monitorozás, amely regionális epileptiform mintákat (akut-lassú hullám), folyamatos regionális lassulást az egyik frontális elvezetésben, a másodlagos kétoldali szinkronizáció jelenségét tárja fel.
A szerkezeti hiba kimutatására MRI-t végeznek.
A kezelés megkezdése topiramáttal (topamax) kezdődik, 12,5-25 mg / nap kezdő adaggal. Az adagot fokozatosan, hetente egyszer 12,5-25 mg-mal emelik 50-500 mg / napra (3-10 mg / kg / nap), 2 adagban (reggel és este), 12 órás időközönként. a második választás a karbamazepin, 600-1800 mg / nap (15-35 mg / kg / nap) dózisban, naponta kétszer. A karbamazepin és az oxkarbazepin különösen hatékonyak a dialepsziában. "ál-generalizált rohamokkal"
lágyék” és a másodlagos kétoldali szinkronizáció jelensége az EEG-n, a karbamazepin ellenjavallt, mert súlyosbíthatja a rohamokat.
A harmadik választás eszközeit - a valproinsav-készítményeket (convulex, depakin, convulsofin) 1000-3000 mg / nap (30-60 mg / kg / nap) dózisban használják naponta kétszer.
A három alapvető gyógyszer hatástalansága miatt politerápia javasolt - topiramát vagy valproát kombinációja szukcinimidekkel. Az etosuximidet (suxilep) 500-1000 mg/nap (20-40 mg/ttkg/nap) dózisban, 3 részre osztva írják fel. Más esetekben az alapvető AED-ek kombinációját írják elő: topiramát + valproát, valproát + karbamazepin, karbamazepin + topiramát.
A politerápia tartalék gyógyszerei a lamotrigin (lamiktál) és a levetiracetam (keppra). A lamotrigin (3-7 mg/ttkg/nap) csak alap AED-ekkel együtt alkalmazható. Átlagos adagok - 100-400 mg / nap topiramáttal vagy karbamazepinnel és 100-200 mg / nap valproáttal kombinálva. A levetiracetám 1000-4000 mg/nap (30-60 mg/ttkg/nap) dózisú alap AED-ekkel kombinálva hatásos fokális motoros és másodlagos generalizált rohamok esetén.
A betegség prognózisa SLE-ben mindig súlyos, ami a kéreg szerkezeti hibájával, hemiparézissel és súlyos kognitív károsodással jár. Az orvosi remisszió csak a betegek 20% -ánál érhető el. Más esetekben lehetőség van a rohamok gyakoriságának jelentős csökkentésére. Rezisztens rohamok esetén használatos sebészet. A műtét fő típusa a fokális kortikális reszekció.
Tünetekkel járó temporális lebeny epilepszia (SVE) ismert etiológiájú és morfológiai rendellenességekkel járó lokálisan kondicionált forma az agy halántéklebenyében (Ammon-szarv-szklerózis, jóindulatú halántéklebeny-daganatok, fokális kérgi diszplázia, perinatális károsodás következménye). Az SVE-nek két fő formája van: limbikus (szinonimák: paleokortikális, amygdalo-hippocampus) és neokortikális (szinonimája: laterális).
Az esetek 75%-ában rohamok kezdődnek aurák. Az aura fogalmát egyértelműen meg kell határozni, és meg kell különböztetni az epilepsziás roham előfutáraitól. Az Aura (görögül - lélegzet) alatt olyan klinikai jelenségeket kell érteni, amelyek önmagukban fordulnak elő
vagy másodlagos generalizált vagy részleges roham előtt. Az aurát egy helyi epilepsziás váladék okozza az agykéreg egy bizonyos területén, és valójában egy egyszerű részleges roham. Az aura természete jelzi a fókusz lokalizációját. A következő típusú aurákat különböztetjük meg: szomatoszenzoros, vizuális, szagló, ízlelési, hallási, szédülés, mentális, autonóm, hasi (hasi). Hírnökök percekkel, órával vagy nappal az epilepsziás roham előtt fordulnak elő, általában mentális vagy vegetatív tünetekként jelentkeznek, és nem kísérik helyi kérgi váladékozás.
Amygdalo-hippocampus (paleokortikális, limbikus) - a leggyakoribb forma, amely az összes SVE-eset körülbelül 65% -át teszi ki. A betegség hátterében gyakran a halántéklebeny mediobazális részének szklerózisa (gliózisa) áll perinatális károsodás vagy atipikus lázgörcsök következtében. A betegség általában 3 éves kor előtt elhúzódó, gyakran hemiklónusos, lázas rohamokkal kezdődik. Ezt követi a képzeletbeli jólét időszaka – a támadások a pubertás előtti időszakig hiányoznak. A legjellemzőbbek (az esetek 70%-a) az eszméletvesztéssel járó összetett fokális rohamok (dialeptikus) vagy automatizmusok (automotoros). Dialeptikus rohamok esetén a beteg hirtelen leállítja a motoros tevékenységet, tágra nyílt szemekkel lefagy, tekintete csodálkozást vagy ijedtséget fejez ki („meredező tekintet”).
Az SVE-t a gesztusok (kéz, ujjak dörzsölése, kézszorítás, ruhák szétválogatása) és száj-táplálkozási műveletek (csapás, nyelés, nyalás) formájában megjelenő automatizmusok jellemzik. A kéz automatizmusa a fókusz oldalán figyelhető meg, az ujjak disztóniás beállítása pedig az ellenkező oldalon. Az automotoros rohamok időtartama 30 másodperctől 3 percig tart, gyorsan gyakoribbá válnak és ellenállóvá válnak a terápiával szemben.
A rohamokat gyakran a vegetatív funkciók megzavarása követi. Az epigasztrikus rohamok különösen jellemzőek tiszta tudat esetén. A beteg fájdalmat, teltséget, kényelmetlenséget érez a köldökben; lehetséges a gázok áteresztése. Ez a "felszálló epilepsziás érzés" a hastól a torokig felemelkedik, nyaki összehúzódás érzésével kísérve, ami után a tudat kikapcsolhat.
Jellemzőek az egyszerű gócos rohamok károsodott mentális funkciókkal: Jackson álomállapotai („álomállapotok”), amelyek hirtelen, sajátos érzésekben nyilvánulnak meg.
„ébrenléti álmok”; „már látott” vagy „soha nem látott” érzés; derealizáció (a környezet valószerűtlenségének átérzése) vagy deperszonalizáció (saját személyiség észlelésének megsértése) bekövetkezése. Az amygdala komplexum bevonásával motiválatlan félelem, diszfória és agresszió rövid rohamai jelennek meg.
Laterális (neokortikális) SVE a halántéklebeny felső oldalsó részeinek károsodásával fordul elő. A következő típusú rohamok lehetségesek: hallási hallucinációk (zaj, zene, hangok paroxizmális érzései); vizuális hallucinációk (összetett, fényes panorámás vizuális képek paroxizmális megjelenése, gyakran múltbeli események emlékeinek elemeivel); nem szisztémás szédülés rohamai, gyakran vegetatív megnyilvánulásokkal kombinálva (bőr sápadtsága, hyperhidrosis, tachycardia); paroxizmális szenzoros afázia az epileptogén fókusz lokalizációjával a domináns féltekén; "temporális syncope" eszméletvesztéssel, ernyedéssel és lassú eséssel, görcsök nélkül.
A neurológiai vizsgálat gyakran a fókusz ellenoldali piramis tüneteit tárja fel: a VII és XII agyidegek működésének károsodása, izomtónus aszimmetriája, anisoreflexia, kóros reflexek. A hosszan tartó betegségben szenvedő felnőtt betegeknél személyiség- és kognitív károsodások alakulnak ki, amelyeket a "glischroidia" kifejezéssel jelölnek: viszkozitás, merevség, gondolkodási tehetetlenség, váltási nehézség, apróságokon való "elakadás", affektusok fennmaradása; a memória és a figyelem csökkenése.
EEG az interiktális időszakban az esetek 50% -ában - kóros elváltozások nélkül. A halántéklebenyben a csúcs-hullámaktivitást a betegek legfeljebb 20% -ánál rögzítik.
A coronaria projekcióban végzett MRI-n a hippocampus szklerózisa, az oldalkamra alsó szarvának kitágulása, az érintett halántéklebeny térfogatának csökkenése, esetenként fokális kérgi dysplasia is kimutatható.
A kezelést karbamazepin készítményekkel (finlepsin retard, tegretol CR) kezdjük, 600-1800 mg/nap (15-35 mg/ttkg/nap) dózisban, 2 adagban 12 órás időközönként vagy 3 adagban, 8- órás intervallum. Az oxkarbazepint (trileptál) 600-2400 mg/nap (20-40 mg/ttkg/nap) dózisban írják fel. A második választási gyógyszert - a topiramátot - úgy írják elő, hogy az adagot naponta kétszer 100-400 mg-ra (4-8 mg / kg / nap) fokozatosan növelik.
A harmadik választás eszközei - a valproinsav-készítményeket 1000-3000 mg / nap (30-70 mg / kg / nap) dózisban alkalmazzák 2 vagy 3 adagban, egyenlő időközönként.
A három alapgyógyszer hatástalansága miatt politerápia javasolt: karbamazepin (vagy oxkarbazepin) kombinációi valproáttal, topiramáttal; valproát topiramáttal. Tartalék gyógyszerek politerápiához - lamotrigin (3-7 mg / kg / nap, csak alap AED-ekkel kombinálva) és levetiracetám.
P előrejelzés. Az orvosi remisszió csak a betegek 1/3-ánál érhető el. A fennmaradó betegeknél a legtöbb esetben jelentősen csökkenthető a rohamok gyakorisága. Gyógyszerrezisztens esetekben sebészeti kezelést alkalmaznak, különösen szelektív amygdala-hippocampotomiát.
Tünetekkel járó occipitalis epilepszia (SZE) epileptogén fókusz jelenléte és morfológiai elváltozások jellemzik az occipitalis régióban. Etiológiai tényezők a fokális kérgi diszplázia, a perinatális elváltozások következménye, az occipitalis meszesedés coeliakiával, az érrendszeri rendellenességek (Sturge-Weber-szindróma), a MELAS, a progresszív myoclonus epilepszia Lafora testekkel, daganatok, stroke az agyi artéria hátsó medencéjében.
A SES kezdetének kora változó. A következő típusú görcsrohamokat állapítják meg: egyszerű fokális szenzoros látászavarok (makro-, mikropszia, elemi vizuális hallucinációk), szemmozgási zavarok (a fej és a szemek fókuszával ellentétes irányú elfordulása, erőltetett paroxizmális pislogás, nystagmus); vegetatív-zsigeri (hányinger, hányás, fejfájás); másodlagos generalizált görcsös. Gyakran amaurosis és homonim kvadráns hemianopsia figyelhető meg a roham szerkezetében (vagy a prolapsus támadás utáni tüneteiként). Jellemző a roham utáni migrénszerű fejfájás.
A neurológiai vizsgálat bizonyos esetekben sztrabizmust, amblyopiat, látómezők beszűkülését vagy hemianopsiát állapít meg. Az interiktális periódusban végzett EEG vizsgálat az SZE-ben szenvedő betegek 30%-án nem mutatott kóros elváltozásokat. Gyakrabban regionális lassító vagy csúcshullámú epileptiform aktivitást határoznak meg az egyik occipitalis elvezetésben vagy biooccipitálisan, a fókusz oldalán amplitúdó túlsúlyban.
A neuroimaging feltárja az occipitalis kérgi diszpláziát, a korábbi perinatális encephalopathia (ulegiria) miatti lokális gliózist, meszesedéseket és érrendszeri rendellenességeket.
Kezeléskezdje a karbamazepin-készítményekkel 600-1800 mg / nap (15-35 mg / kg / nap) dózisban, 2 adagban, 12 órás intervallummal. A karbamazepin nagy dózisban különösen hatásos izolált vizuális aurák és gócos rohamok esetén, amelyek károsodott vegetatív funkciókkal járnak. Sok szerző javasolja az SZE-kezelés megkezdését oxkarbazepinnel 600-2400 mg/nap (20-40 mg/nap) dózisban.
A második választási gyógyszer - a topiramátot 100-400 mg / nap (5-8 mg / kg / nap) adagban írják fel naponta kétszer. Másodlagos kétoldali szinkronizálással az EEG-n a Topamax kiindulási gyógyszer lehet.
A választott gyógyszer a valproinsav. Átlagos adagok - 1000-2000 mg / nap (30-60 mg / kg / nap), ha szükséges - magasabbak, 2 vagy 3 adagban.
Rezisztens esetekben politerápiát alkalmaznak. Különösen hatékonyak a karbamazepin (vagy oxkarbazepin) valproáttal, valproát topiramáttal, ritkábban karbamazepin és topiramát kombinációi. Egy második gyógyszer hozzáadásakor az első adagja általában nem csökken. A politerápia tartalék gyógyszerei a lamotrigin és a levetiracetám.
Előrejelzésfügg az agy szerkezeti hibájának természetétől és a gerjesztés terjedésének útjaitól a kéregben. A betegek 40-50%-ában stabil orvosi remisszió érhető el. Rezisztens SZE-esetekben az AED-k használatának hatásának hiányában a betegek számára az egyetlen igazi segítség az idegsebészeti beavatkozás - corticalis reszekció.
Kozhevnikov epilepsziája és Rasmussen agyvelőgyulladása (EC) polietiológiás betegség, amely myoklonusos, fokális motoros, másodlagos generalizált rohamok és fokális neurológiai tünetek kombinációjában nyilvánul meg.
A betegséget először Alekszej Jakovlevics Kozsevnyikov orosz neurológus írta le "epilepsia corticalis sive partialis continua" néven. 1894. január 21-én az általa létrehozott Moszkvai Neurológusok és Pszichiáterek Társaságának ülésén előadást tartott "A kortikális epilepszia egy speciális típusáról" témában. A jelentés 4 agykérgi epilepsziás eset vizsgálatán alapult, amelyeket a szerző a moszkvai idegbetegek klinikáján figyelt meg.
a betegség eredeti leírása, addig még nem ismert. A betegség klinikai képe mind a 4 betegnél rendkívül hasonló volt: „... generalizált epilepsziás rohamok kombinációja állandó klónos görcsökkel a test szigorúan meghatározott részein. Ezekből az állandó görcsökből alakultak ki: 1) tipikus jacksoni rohamok az egyik testfélben és 2) a fent említett általános rohamok, amelyek szintén a jacksoni típus szerint alakultak ki. Ennek a betegségnek egy másik nevét N.F. professzor javasolta. Filatov - "Kozhevnikov epilepsziája". A múlt század 40-es éveiben az EK és a tavasz-nyár kapcsolata kullancs által terjesztett agyvelőgyulladás(orosz agyvelőgyulladás).
1958-ban T. Rasmussen és J. Obzhevsky leírta a krónikus fokális encephalitis klinikai képét, amelynek egyik fő tünete az EK volt. Később ezt a betegséget Rasmussen-encephalitisnek vagy Rasmussen-szindrómának (SR) nevezték el. Mostanáig rejtély marad, hogy milyen betegség A.Ya. Kozhevnikov leírta az EC tünetegyüttesét - orosz encephalitis vagy Rasmussen-encephalitis esetén. Véleményünk szerint A.Ya. A Moszkvában gyakorló Kozsevnyikov epilepszia formáját pontosan a krónikus fokális agyvelőgyulladással írta le, mivel az általa bemutatott kórtörténetek egyike sem utal a betegeknél elszenvedett akut encephalitisre.
A kullancs által terjesztett agyvelőgyulladáson kívül az EC-k tuberkulózisos meningoencephalitist, neurosifiliszt, traumás agysérülést, agydaganatot, fokális kérgi diszpláziát, örökletes betegségek csere.
Krónikus fokális encephalitis [Rasmussen-encephalitis, Rasmussen-szindróma (SR)]. Az SR egy súlyos agyi betegség - krónikus progresszív fokális encephalitis. A betegséget klinikai tünetegyüttesek hármasa jellemzi: epilepsziás rohamok (mint a Kozhevnikov-epilepszia), mozgászavarok (centrális hemiparézis) és a magasabb mentális funkciók zavara. Etiológiája ismeretlen, feltehetően a vírusos etiológiájú lassú idegfertőzéseknek tulajdonítható a betegség, de a vírust nem azonosították.
Debütálás gyermekkorban - 1 és 14 év között, csúcsponttal 5-6 éves korban epilepsziás rohamokkal (fokális motoros vagy másodlagos generalizált, ritkábban - dialeptikus); az esetek 20% -ában - epilepsziával
tic állapot. Gyakran előfordul szomatoszenzoros aura (égő, bizsergő, zsibbadás). Már a betegség kezdeti szakaszában átmeneti postictalis monoparesis (vagy hemiparesis) alakul ki - Todd-paresis. Általában néhány hónappal az első gócos rohamok megjelenése után hosszú távú (akár több napos), majd állandó, a törzs egyik felében és a végtagokban lokalizált myoklonusos rohamok csatlakoznak hozzájuk, amelyek generalizált rohamokká alakulhatnak át. görcsök. Ez a tünetegyüttes Kozhevnikov epilepsziája. Idővel az epilepsziás myoclonus átterjed az összes végtagra, az arcizmokra és az elülső izomzatra hasfalés állandósul, még álomban sem tűnik el. Perzisztens hemiparesis alakul ki. A vezetési típus érzékenységének megsértése és a látómezők elvesztése áll fenn. A kognitív károsodás, a dysarthria egyre növekszik. Az esetek 25%-ában lehetséges az elhízás és a korai szexuális fejlődés.
Az EEG-n a betegség előrehaladott stádiumában az esetek 100%-ában a háttér fő tevékenységének progresszív lassulása, folyamatos regionális lassulás (frontotemporális elvezetésekben); folyamatos csúcshullámtevékenység. Mivel az epileptiform aktivitás előrehaladása diffúz módon történik.
A neuroimaging kritikus a diagnózisban. Az agy MRI-je a hemiatrophia növekedését mutatja a dinamikában. Az atrófia általában a parietális-temporális régióban kezdődik a szilviai hasadék lokális kiterjedése formájában, és idővel "olajfoltként" terjed a sütőpapír lapján, megragadva az "egészséges" féltekét.
Az EC rezisztens epilepsziás szindrómákra utal. A terápia megkezdése - valproátok (depakin, convulex, convulsofin) nagy dózisokban: 50-100 mg / kg / nap. Ezenkívül a valproát és a levetiracetám vagy topiramát kombinációja javasolt. A levetiracetám hatásosnak bizonyult fokális motoros, másodlagos generalizált és myoklonusos rohamokban az EK-n belül, dózisa 30-70 mg/ttkg/nap. A topiramát adagja körülbelül 10 mg/kg/nap. A betegség előrehaladott stádiumában barbiturátok (fenobarbitál 5-8 mg / kg / nap) alkalmazása lehetséges. Az etosuximid (legfeljebb 30 mg/ttkg/nap) hozzáadása az alapvető AED-ekhez bizonyos esetekben hatékony lehet rezisztens myoklonusos rohamok esetén.
A benzodiazepineket (klobazám 1 mg/ttkg/nap vagy klonazepám 0,5-4,0 mg/nap) alkalmazzák visszatérő görcsrohamok és állapotlefolyás esetén. A karbamazepin monoterápiaként történő kijelölése nem javasolt a myoklonusos rohamok esetleges súlyosbodása miatt.
Maga az encephalitis kezelésében különféle gyógyszereket használnak: vírusellenes (zidovudin, acyclovir, ganciklovir); hormonális (metilprednizolon intravénásan 400 mg / m 2 testfelület 3 napig; prednizolon, dexametazon); immunglobulinok (oktagam, IVIC 400 mg/kg/nap intravénásan 3 napig); citosztatikumok (azatioprin, ciklofoszfamid), plazmaferézis. azonban adott kezelést csak lassíthatja a betegség előrehaladását.
Hatékony idegsebészeti beavatkozás a funkcionális hemisferotomia, amelyet a lehető legkorábban el kell végezni. A műtét utáni stabil remisszió gyakorisága 23-52%. Sebészeti kezelés nélkül az SR előrehalad, és a kezdettől számított 2-15 éven belül (átlagosan 3 éven belül) végzetesen végződik. A betegség spontán stabilizálódásának külön eseteit írják le.
14.3. Az epilepszia idiopátiás generalizált formái
Csecsemőkori jóindulatú myoklonus epilepszia 4 hónapos és 3 éves korában debütál. Csak a myoclonus rohamok jellemzőek aktív myoclonus formájában a nyak izmaiban és a felső végtagok proximális részeiben: rövid bólintások a törzs enyhe előrebillentésével, a vállak azonnali felemelése és a könyökök oldalra terjesztése. Általában a rohamok sorozatosak, ébredés után egyre gyakoribbá válnak. A tudat nem zavart. Az alsó végtagok myoklonusos rohamai sokkal ritkábban fordulnak elő - a lábak azonnali hajlítása enyhe guggolással, és akár egy esetleges hirtelen esés a fenékre.
A neurológiai állapot izom hipotenziót és ataxiát mutatott ki. A pszichomotoros fejlődés nem befolyásolja. Az EEG-n a fő tevékenység nem változik; az epileptiform aktivitást csak a roham idején rögzítik. A generalizált policsúcs-hullámaktivitás rövid kisülései jellemzik, amelyek a myoklonus rohamokkal szinkronban fordulnak elő. A videó-EEG monitorozás elengedhetetlen a rövid myoklonus rohamok rögzítéséhez. A neuroimagingben nincs változás.
Indulás kezelés valproinsav-készítményekkel végezzük. Rendeljen convulexet vagy depakint szirupban vagy cseppekben (1-2 év múlva - tabletták) 300-1500 mg / nap (15-50 mg / kg / nap) adagban. A legtöbb esetben remisszió következik be. Hatástalanság esetén politerápiát alkalmaznak; ugyanakkor a valproátok mindig az alapvető AED-ek maradnak. Rendelje hozzá a valproátok és a szukcinimidek kombinációját (etosuximid 250-750 mg / nap dózisban, 15-25 mg / kg / nap, 2-3 adagban). A valproát és a topiramát lehetséges kombinációi 25-100 mg / nap (3-5 mg / kg / nap) dózisban 2 adagban; valproátok benzodiazepinekkel, például klobazámmal (frizium) 5-20 mg / nap (0,5-1,0 mg / kg / nap) dózisban, 2 részre osztva. A karbamazepin és a lamotrigin felírása korlátozott a myoklonusos rohamok súlyosbodásának lehetősége miatt.
Előrejelzéskedvező. A mentális fejlődés nem szenved, és a gyógyszeres remisszió az esetek csaknem 100% -ában következik be. A terápia időtartama 3 év, a relapszusok rendkívül ritkák.
Epilepszia myoklonus-asztatikus rohamokkal (Doose-szindróma) 1-5 éves korban debütál, gyakrabban generalizált görcsrohamokkal, amelyek a nap bármely szakában előfordulnak. Az esetek 11%-ában lázgörcsöket jegyeztek fel. A tipikus myoclonus és myoclonus-asztatikus rohamok általában csak 3 év elteltével kapcsolódnak össze. A rohamokat rövid, villámgyors, általában aszinkron és aritmiás rándulások jellemzik a lábakban és a karokban, gyakrabban a proximális régiókban. Jellemző a mioklónusos „bólintások” megjelenése, a törzs enyhe meghajtásával és a vállak megemelésével kombinálva („aktív bólintások”). A myoklonusos rohamok gyakorisága nagyon magas lehet; nem ritka, hogy egy percen belül vagy akár folyamatosan ismétlődő rohamok jelentkeznek, különösen ébredés után (status epilepticus). Az alsó végtagok myoklonusos görcsrohamainál lépcsőzetes guggolások fordulnak elő, esetlegesen hirtelen térdre vagy fenékre eséssel (mioklónusos-asztatikus rohamok); miközben a tudat megmarad. A hiányt a betegek 60-90% -ánál figyelik meg. Túlsúlyban vannak a rövid tipikus egyszerű hiányzások, valamint a myoklonus komponensű hiányok. A hiányzások gyakorisága magas, maximum a reggeli órákban.
A neurológiai állapotban egyoldalú piramis tünetek, koordinációs zavarok figyelhetők meg; az idő felében - durva
késleltetett pszichoverbális fejlődés. Az EEG a csúcs- és többcsúcs-hullámaktivitás rövid általános és regionális kisüléseit mutatja. A neuroimaging változások általában hiányoznak; egyes esetekben a kéreg mérsékelt szubatrophiája figyelhető meg.
Indulás kezelés valproinsav-készítményekkel 600-1750 mg / nap (20-100 mg / kg / nap) dózisban. A választott gyógyszer a topiramát 2 részletben, 50-200 mg/nap (3-7 mg/ttkg/nap) dózisban. Hatástalanság esetén politerápiát alkalmaznak; ugyanakkor először a valproátok, majd a topiramát marad az alapvető AED. Használjon valproátot szukcinimidekkel, valproátot topiramáttal, valproátot benzodiazepinekkel. Egyes rezisztens esetekben három AED felírására van lehetőség: valproátok, topiramát és szukcinimidek (vagy benzodiazepinek). A karbamazepin alkalmazása ellenjavallt a myoklonusos rohamok súlyosbodásának lehetősége miatt.
Előrejelzés.A legtöbb gyermeknek sikerül megállítania a rohamokat. A betegek hozzávetőleg 1/3-ánál az epilepsziás rohamok továbbra is fennállnak, tónusos rohamok és atipikus hiányzások csatlakoznak, és a kognitív hiba elmélyül.
Az epilepszia hiányos formái. A hiányzások leggyakrabban és jól tanulmányozott formái a gyermekkori és fiatalkori távolléti epilepszia. Jellemző hiányzásokban nyilvánulnak meg - rövid, primer generalizált rohamok eszméletvesztéssel, elhalványulással, minimális motoros jelenségekkel és szimmetrikus, kétoldali szinkron csúcshullám-aktivitás jelenléte az EEG-n másodpercenként 3 vagy több komplex gyakorisággal (14.2. ábra). Vannak egyszerű (motoros komponens nélküli fading) és összetett (minimális motoros jelenségekkel) hiányok. Bonyolultabbak a tonikkal való hiányzások (fej hátradöntése, szemek felemelése), myoklonus (indulás, szemhéj, szemöldök, orrszárnyak, vállrándulás), atonikus (fej mellkasra ejtése, törzs megdöntése), vegetatív (a bőr elszíneződése, akaratlan vizelés), valamint aszimmetrikus megnyilvánulásokkal (például a fej enyhe elfordításával). A távolléti rohamok időtartama 2-30 másodperc, gyakorisága napi 100 vagy több.
Gyermekkori hiányepilepszia (piknolepszia) az epilepszia leggyakoribb formája. A mutáns GABA receptor géneket feltérképezték

Rizs. 14.2.EEG roham alatt (hiány)
több kromoszóma lókusz: 6p, 8q24, 15q24. A betegség 3-9 éves korban jelentkezik, jellemző hiányzásokkal. Ritka esetekben a betegség generalizált görcsrohamokkal kezdődik, amit hiányzások követnek. A lányok gyakrabban betegek. A rohamok jellegzetes típusa a tonizáló komponenssel járó hiányrohamok: a fej enyhe megbillenése és a szemgolyók kialakulása. A rohamokat hiperventiláció, ritkábban orális számlálás váltja ki. Nem megfelelő kezelés esetén a betegek körülbelül 30%-a csatlakozik a GSP-hez. A hiperventiláció során az EEG-n a csúcshullám-aktivitás folyamatos generalizált kisülései 3 Hz-es frekvenciával jelennek meg. Az MRI nem mutat változást.
Anti-absence aktivitással rendelkeznek: valproátok, szukcinimidek, benzodiazepinek, lamotrigin, topiramát. A kábítószerek használata
A karbamazepin ellenjavallt, mert fokozza a görcsrohamokat. A kezdeti kezelést valproinsav-készítményekkel naponta kétszer, 600-1800 mg / nap (30-50 mg / kg / nap) dózisban végezzük. A legtöbb betegnél a rohamok teljesen enyhülnek a valproát monoterápiával. A második választandó gyógyszerek a szukcinimidek. A szukcinimideket monoterápiaként alkalmazzák izolált hiányok jelenlétében, az etosuximid adagja 500-1000 mg / nap (15-30 mg / kg / nap) 3 részre osztva.
Ritka rezisztens esetekben politerápiát alkalmaznak: valproát + szukcinimidek, valproát és lamotrigin. Az esetek 90-97%-ában teljes terápiás remisszió érhető el, általában monoterápiával. A gyógyszerek megszüntetése a rohamok megszűnése után 3 évvel kezdődik.
Fiatalkori hiány epilepszia A (JAE) az epilepszia idiopátiás generalizált formájának egyik formája, amelyet tipikus hiányzás jellemez, amely a pubertás időszakában debütál, és nagy valószínűséggel kapcsolódnak össze HSP- és EEG-elváltozások, általánosított gyors csúcshullám-aktivitás rövid kisülései formájában. Etiológia - a nikotinos acetilkolin receptor gén mutációja, amely az 5., 8., 18. és 21. kromoszómához kapcsolódik. A betegség 9-21 éves korban kezdődik (maximum a pubertás alatt). Az esetek 40% -ában az epilepszia GSP-vel debütál, a többiben - hiányzásokkal. Egyszerű hiányzások jellemzik, rövidebb időtartamú és gyakoriságú, mint a gyermekkorban. Egyes esetekben nagyon rövid (legfeljebb 3 másodpercig tartó) hiányzást észlelnek myoklonus komponenssel: elhalványulás, könnyű szemgolyó felfelé mutató és a szemhéjak gyors rángatózása. A betegek 75%-ánál a hiányzás és a GSP kombinációja van. A görcsös rohamok általában reggel, a betegek felébredése után jelentkeznek. A támadások gyakorisága kicsi - évente 1-4 alkalommal.
Az EEG-t normál alapaktivitás jellemzi, amellyel szemben általánosított gyors (4 Hz) csúcshullám-aktivitás rövid kisülései észlelhetők. Nagy diagnosztikai jelentőségű az epileptiform aktivitás megjelenése alvásmegvonás, ritmikus fotostimuláció és szemzárás során. JAE esetén a fényérzékenység 20,5%, DAE esetén pedig 10%. A JAE hiperventillációjával végzett teszt nem informatív.
A kezdeti terápiát valproinsav-készítményekkel végezzük 900-2000 mg / nap (30-40 mg / kg / nap) dózisban, 2 adagban. Nál nél
monoterápia hatásának hiányában kombinált terápiára térnek át (valproát + topiramát, valproát + szukcinimid).
A teljes terápiás remisszió átlagosan a betegek 70%-ánál érhető el. A terápia megszakítása fokozatosan történik, legalább 4 évig a rohamok teljes hiánya után.
Epilepszia izolált generalizált görcsrohamokkal (epilepszia generalizált ébredési rohamokkal) (EGSP) az idiopátiás generalizált epilepszia egyik formája, amelyben a rohamok egyetlen típusa az aura nélküli primer generalizált tónusos-klónusos rohamok, amelyek egyértelműen az EEG-re fókuszálnak. Az alakot a gének határozzák meg CLCN2 a 3q26 kromoszómán és a genomban CACNB4 a 2q22-23 kromoszómán.
A betegség debütálása széles életkorban - 10 és 30 év között (maximum a pubertás időszakban). A generalizált tónusos-klónusos rohamok aura nélkül fordulnak elő, az ébredés vagy az elalvás időszakára időzítve. Alvásmegvonás (az alvás teljes időtartamának csökkenése, késői lefekvés, szokatlanul korai ébredés) váltja ki őket. A GSP időtartama 30 másodperctől 10 percig terjed, gyakoriságuk alacsony. A legtöbb beteg évente legfeljebb 2-5 rohamot tapasztal.
Az EEG az interiktális időszakban a betegek 50% -ánál normális. Alvásmegvonás után EEG és éjszakai video-EEG monitorozás javasolt. Az interiktális időszakban rövid, generalizált csúcshullám-kisülések figyelhetők meg. A HSP tónusos fázisát az EEG-n egy diffúz, növekvő amplitúdójú, 20-40 Hz-es frekvenciájú gyors ritmus megjelenése jellemzi, amely fokozatosan 10 Hz-re lassul. A klónus fázisban ezt a ritmust fokozatosan felváltja a generalizált policsúcs hullámaktivitás. A támadás utáni relaxáció fázisában a diffúz delta aktivitás a domináns; nincsenek regionális jelenségek.
Az EGSP-vel az AED összes fő csoportja meglehetősen magas hatékonysággal rendelkezik: barbiturátok, hidantoinok, karbamazepin, oxkarbazepin, valproátok, topiramát, levetiracetám. A fenobarbitált és a difenint a kifejezett mellékhatások miatt utolsóként alkalmazzák az alapvető AED-ek hatásának hiányában. A GSP-vel járó epilepszia alapvető gyógyszerei a topiramát, a valproát és a karbamazepin csoport.
A kezelés topiramáttal kezdődik, 100-400 mg/nap (4-10 mg/ttkg/nap) adaggal, 2 részre osztva. A második választandó gyógyszer a valproinsav 1000-2000 mg/nap (30-50 mg/ttkg/nap) dózisban, 2 részre osztva. A harmadik választott gyógyszer a karbamazepin vagy az oxkarbazepin (trileptál).
Egyes rezisztens esetekben barbiturátokkal vagy hidantoinokkal monoterápia lehetséges, ami hatékony, de gyakran súlyos mellékhatások kialakulásához és a betegek életminőségének csökkenéséhez vezet. Ritka rezisztens esetekben politerápiához kell folyamodni. Az optimális kombináció: topiramát + valproát; míg a gyógyszerek adagjai változatlanok maradnak.
A betegek 90%-ában remisszió érhető el. A hatás hiánya gyakran téves diagnózissal jár. Nem megfelelő kezelés esetén absans rohamok vagy myoclonus csatolása lehetséges JAE-vé és JME-vé történő átalakulással.
Fiatalkori myoclonus epilepszia (JME - Yants-szindróma) az idiopátiás generalizált epilepszia egyik formája, amelyet serdülőkorban kezdődően és masszív myoklonusos rohamok jelenléte jellemez, amelyek főként a betegek felébredését követő időszakban fordulnak elő.
A JME egy heterogén betegség, amely számos gén mutációjával jár, beleértve a GABRA1 gén(OMIM 137160) az 5q34-q35 kromoszómán, CACNB4 gén(OMIM 601949) a 2q22-q23 kromoszómán és mutáció CLCN2-gén (OMIM 600570) a 3q26 kromoszómán. Az epilepszia kockázata azokban a családokban, ahol az egyik szülő JME-ben szenved, körülbelül 8%. Az EEG-n általánosított csúcshullám-aktivitást a proband JME-ben szenvedő klinikailag egészséges rokonainak 18%-ánál figyeltek meg.
A betegség 7-21 éves korban kezdődik, maximum 11-15 éves korban. A rohamok fő típusa a myoklonus paroxizmus, amelyet különböző izomcsoportok villámgyors rángatózásai jellemeznek. Gyakrabban kétoldaliak, szimmetrikusak, egyszeresek vagy többszörösek, változó amplitúdójúak; gyakran sortüzek formájában jelennek meg. Főleg a vállövben és a karokban lokalizálódnak, főleg a feszítő izomcsoportokban. A tudat a myoklonusos rohamok alatt megmarad. A betegek 30%-ánál a myoklonusos rohamok a láb izmait ragadják meg, miközben a beteg hirtelen ütést érez a térde alatt, és enyhén megkuporodik vagy elesik (mioklónikus-asztatikus rohamok). Mioklónusos rohamok jelentkeznek, ill
gyakoribbá válnak az ébredés utáni első percekben és órákban. A csökkent ébrenlét, álmosság, ásítás, a szemek eltakarása növeli a reggeli rohamok valószínűségét.
Az esetek 90% -ában a mioklónusos rohamokat ébredő GSP-vel kombinálják - ezt a rohamtípust klónikus-tónusos-klónikusnak nevezik. A betegek 40%-ánál csatlakoznak a rövid hiányzások.
A provokáló tényezők az alváshiány és a hirtelen kényszer ébredés. Egyes betegeknél a myoklonusos rohamok kizárólag alváshiány miatt fordulnak elő. A JME-s betegek megközelítőleg 1/3-ánál (gyakrabban nőknél) vannak fényérzékeny rohamok: televíziózás, számítógépes játékok, diszkókban villódzó fények váltják ki őket. A fő EEG mintázat a generalizált gyors policsúcs-aktivitás rövid kisülései, amelyeket a betegek 80-95%-ánál észlelnek az interiktális időszakban. A legjellemzőbb általánosított gyors (4 Hz és nagyobb) policsúcs-hullám aktivitás. Az EEG-t JME-vel kora reggel kell elvégezni egy alvásmegvonásos éjszaka után.
A JME differenciáldiagnózisát tickkel, choreával, valamint a myoclonusos progresszív epilepszia különféle formáival végzik. A gyógyszeres terápia mellett szigorúan be kell tartani az alvási és ébrenléti rendet; kerülje a fotostimuláció tényezőit a mindennapi életben.
Kezdeti kezelés - valproinsav-készítmények 1000-2500 mg / nap (30-50 mg / kg / nap) dózisban. A lányoknál jelentkező mellékhatások (menstruációs zavarok, elhízás, hirsutizmus, policisztás petefészek, csökkent termékenység) elkerülése érdekében a kezelés monoterápiaként topiramáttal vagy levetiracetámmal kezdhető. A topiramátot 200-400 mg/nap (5-10 mg/ttkg/nap) dózisban írják fel 2 részre osztva. A levetiracetámot 30-60 mg/ttkg/nap dózisban írják fel
(1000-3000 mg / nap) 2 részre osztva.
Nem megfelelő hatékonyság esetén politerápiát írnak elő: valproátok + szukcinimidek (rezisztens hiányokkal); valproát + topiramát vagy levetiracetám (rezisztens GSP-vel); valproátok + benzodiazepinek (súlyos fényérzékenységgel). A karbamazepin készítmények ellenjavallt.
A betegek 85-95% -ánál teljes orvosi remisszió érhető el, és a legtöbb esetben monoterápia alkalmazásakor. A probléma az AED-k leállítása utáni magas kiújulási arányban rejlik. A gyógyszerek törlése még 4-5 év teljes klinikai remisszió után is okozza
a rohamok kiújulása a betegek legalább 50%-ánál. Az AED fokozatos leállítása legkorábban 4 év rohammentes év után javasolt.
14.4. Csecsemő- és gyermekkori epilepsziás encephalopathiák
West szindróma - a generalizált epilepszia tüneti vagy kriptogén formája, amelyet infantilis görcsrohamok, EEG-hipsarrhythmia, pszichomotoros retardáció jellemez. A betegség az 1. életévben debütál, főként 6-8 hónapos korban. A rohamok fő típusa a hajlító infantilis görcsök („Salaam rohamai”): a gyermek meghajlítja a fejét és a törzsét, felemeli és behajlítja karjait és lábait. A támadások nagyon rövidek, másodpercek; gyakran sorozatokba csoportosítva - akár 100 vagy több görcs 1 sorozatban. Naponta legfeljebb 10-50 epizód figyelhető meg az ébredés utáni növekedéssel. Egyes esetekben a görcsök kifejezett aszimmetriája lehetséges, másokban - a törzs és a végtagok kiterjesztése (extensor tónusos görcsök). Gyakran a pszichomotoros fejlődés és a tetraparesis kifejezett késése van. Tüneti esetekben a neurológiai állapot változásait röviddel a születés után észlelik; kriptogénnel - csak a rohamok megjelenésével.
Az EEG-t diffúz, szabálytalan, nagy amplitúdójú lassúhullámú aktivitás jellemzi, finom tüskekomponenssel - hypsarrhythmia. Az epileptiform mintázatok lehetséges aszimmetriája és túlsúlya az occipitalis elvezetésekben (14.3. ábra).
A neuroimaging feltárja a diffúz atrófiát, az agy fejlődési rendellenességeit és a perinatális encephalopathia következményeit. A betegség kialakulásának külön okaként megkülönböztetik a gumós szklerózist, valamint néhány örökletes degeneratív és anyagcsere-betegséget.
Infantilis görcsök esetén a gyógyszer korai beadása szükséges. A kezdeti terápia vigabatrinnal (sabril) kezdődik - 50-100 mg / kg / nap vagy valproát - 50-100 mg / kg / nap. A topiramát (Topamax) 5-10 mg/ttkg/nap dózisban második vagy harmadik választandó gyógyszer lehet. Rezisztens rohamok esetén ezeknek az alapvető AED-eknek a kombinációja benzodiazepinekkel (klonazepám 0,25-2 mg/nap, klobazám 1 mg/ttkg/nap) vagy fenobarbitállal (5-15 mg/ttkg/nap), valamint suxilep-pel (15- 30 mg/kg/nap). Aszimmetrikus rohamok esetén karbamazepin (finlepsin, tegretol) adható hozzá 10-20 mg/ttkg/nap dózisban.

Rizs. 14.3.EEG West-szindrómában (hypsarrhythmia)
Alternatív módszer a kortikoszteroid hormonok (intramuscularis synacthen depot; dexametazon, orális prednizolon) és immunglobulinok (oktagam) alkalmazása. A prednizolon átlagos adagja 1-2,5 mg / kg / nap, amelyet át kell térni a minimális fenntartó dózisra. A hormonokat általában az alapvető AED-ekkel együtt írják fel. A szteroidos kezelést a klinika szakemberei végzik a súlyos mellékhatások veszélye miatt.
A prognózis nehéz. A modern AED-k a betegek 60%-ánál teszik lehetővé a rohamok megállítását, azonban a legtöbb esetben kifejezett intellektuális hiba és autista viselkedés marad fenn. Ha a rohamok továbbra is fennállnak, súlyos multifokális epilepsziává vagy Lennox-Gastaut szindrómává alakul át.
Lennox-Gastaut szindróma (gyermekkori epilepsziás encephalopathia diffúz lassú csúcshullámokkal az EEG-n) (SLH) - kriptogén (tünetekkel járó) generalizált epilepszia, amelyet gyakori polimorf rohamok, specifikus változások az EEG-ben, csökkent intelligencia és terápiával szembeni rezisztencia jellemeznek. Az etiológia a legtöbb esetben ismeretlen. A PSH az epilepszia egyik legsúlyosabb formája.
A betegség gyakrabban 3-8 éves korban jelentkezik. Jellemző a rohamok hármasa, amely az esetek közel 100%-ában megfigyelhető: tónusos axiális, atipikus hiányzások és esések rohamai. A tónusos rohamok a törzs és a végtagok izomzatának rövid, intenzív feszültségében nyilvánulnak meg, gyakrabban fordulnak elő éjszaka. Néha hosszabbak, és a végtagok enyhe, klónikus rángatózásai (tónusos-vibrációs rohamok) és súlyos autonóm tünetek (apnoe, bradycardia) kísérik. Az atipikus távollétekre a rohamok fokozatosabb kezdete és vége jellemző, mint a tipikus hiányzásokra; a tudat gyakran ingadozik; atonikus jelenségek figyelhetők meg (a fej mellkasra esése, a vállak leengedése, a törzs dőlése, a lábak meghajlása). Az esések támadásai lehetnek éles tonizáló jellegűek ("esés, mint egy szobor"), vagy simábbak - myatonikusak (kezdeti myoklonus komponens, majd atónia). Az esések során a gyerekek különféle sérüléseket kapnak a fejükön és a törzsükön. Egyes esetekben myoklonus és generalizált görcsrohamok figyelhetők meg; gócos rohamok megjelenése a vita tárgya. Jellemzője a rohamok legmagasabb gyakorisága az alvás növekedésével, ébredéskor, passzív ébrenlét során. Éppen ellenkezőleg, az aktív ébrenlét hozzájárul a rohamok csökkenéséhez ["az agytevékenység a rohamok antagonizmusa" (Gastaut)]. A PH-ban szenvedő betegeknél nagy a sorozatos rohamok és a status epilepticus (tónusos rohamok és atipikus hiányzások) kockázata. A tónusos rohamok állapota közvetlen veszélyt jelenthet a betegek életére.
A neurológiai státuszban diffúz izom hipotenziót és ataxiát határoznak meg. A piramis traktus károsodásának tünetei általában hiányoznak. Az intelligencia minden esetben csökken; hiperaktív, autista vagy pszichopata viselkedés figyelhető meg.
Az EEG-n három fő mintázat derül ki: a háttérfelvétel fő tevékenységének lelassulása, akut-lassú hullám lassú diffúz komplexumai, gyors (10-20 Hz) aktivitási lefutások, gyakrabban alvás közben (14.4. ábra).
A neuroimaging nem tár fel helyi szerkezeti hibákat az agyban; legtöbb esetben diffúz kortikális atrófiát határoznak meg.
A kezelést a táblázat tartalmazza. 23.

Rizs. 14.4.EEG Lennox-Gastaut szindrómában
23. táblázatLennox-Gastaut szindróma kezelése
Az epilepszia elleni gyógyszerek vezető helyet foglalnak el a PH kezelésében; minden más módszer segédeszköz. A kezdeti terápia topiramáttal kezdődik. Kezdő adagja általában
12,5 mg/nap A lehetséges mellékhatások elkerülése érdekében lassú dózistitrálás javasolt - heti 12,5 mg-os emelés. A topiramát adagja 75-350 mg/nap (3-10 mg/ttkg/nap) vagy több, 2 részre osztva. A választott gyógyszer a valproinsav. A valproinsav-készítményeket fokozatosan emelik 900-2500 mg / nap (40-80) mg / kg / nap és a felett a maximális tolerált dózisig.
A monoterápia elégtelen hatása esetén (a legtöbb esetben) a gyógyszerek kombinációjára való átállás javasolt: topiramát + valproát, valproát + szukcinimidek, valproát vagy topiramát + lamotrigin. A szukcinimideket 500-1000 mg/nap (20-35 mg/ttkg/nap) dózisban, 3 részre osztva alkalmazzák. A lamotrigin napi 12,5 mg-mal kezdődik, hetente egyszer 12,5 mg-mal növelve az adagot; a gyógyszer átlagos adagja 75-200 mg / nap (3-7 mg / kg / nap) 2 adagban.
Kezelésrezisztens tónusos rohamok esetén a karbamazepin hozzáadható az alapvető AED-ekhez. Ezekben az esetekben az optimális séma a valproát + karbamazepin. A karbamazepineket kis vagy közepes adagokban kell felírni, és csak alap AED-ekkel kombinálva. A karbamazepinek átlagos adagja 100-600 mg / nap (10-20 mg / kg / nap) 2 részre osztva. A levetiracetám 1000-3000 mg/nap (30-60 mg/ttkg/nap) dózisban hatásos lehet myoklonus és generalizált rohamok esetén. A tónusos rohamok túlsúlyával a valproátok és a hidantoinok kombinációja lehetséges. A difenint 75-200 mg / nap (3-7 mg / kg / nap) dózisban alkalmazzák 2 adagban.
A folyamatban lévő terápia hatásának hiányában a kezelési rendben lehetséges a benzodiazepinek és az alapvető antiepileptikumok kombinációja. A benzodiazepinek közül csak a klobazám alkalmazható PH-ban szenvedő betegek hosszú távú kezelésére. A klobazámot 10-30 mg/nap (0,5-1,0 mg/kg/nap) dózisban adják be. Az összes többi benzodiazepint csak „tűzoltó szerként” szabad szájon át beadni a rohamok kontrollálatlan sorozatos növekedésére.
A topiramát + valproát + szukcinimidek (vagy klobazám) a leggyakoribb kombináció rezisztens rohamok esetén PH-ban szenvedő betegeknél.
Előrejelzéskedvezőtlen az SLH számára. Csak a betegek 5-15% -ánál sikerül remissziót elérni. Más esetekben a modern AED-ekkel végzett terápia csökkentheti a rohamok gyakoriságát, elkerülheti a status epilepticus kialakulását, és csökkentheti az intellektuális-mnesztiát.
hiány. A várható élettartam a betegellátástól függ. A betegek többsége súlyosan fogyatékos, önálló életvitelre képtelen.
Landau-Kleffner szindróma [szerzett epilepsziás afázia (SLK)] az epilepszia feltehetően idiopátiás formája. A betegség elektroklinikai képét először V. Landau és F. Klefner írta le 1957-ben. Ez a gyermekkori epilepszia meglehetősen ritka formája, amely szerzett szenzomotoros afáziában nyilvánul meg különféle epilepsziás rohamokkal és diffúz elváltozásokkal kombinálva. az EEG-ben. Az SLK 3-7 éves korban jelenik meg. A betegség megjelenéséig a betegek motoros, mentális és beszédfejlődése megfelel az életkoruknak.
A beszédzavar a betegség fő tünete. Gyakran fokozatosan, több hét vagy hónap alatt alakulnak ki, ritkábban - katasztrofálisan gyorsan, néhány nap alatt. A betegség első tünete általában azonos típusú: a szülők megjegyzik, hogy a gyermek nem reagál megfelelően a megszólított beszédre (érzékszervi afázia megnyilvánulásai). Ebben az időszakban kifejezett viselkedési zavarok jelentkezhetnek: érzelmi labilitás, ingerlékenység, hiperaktivitás; negativizmus, az agresszió kitörései figyelhetők meg. A jövőben a kifejező beszéd megsértése történik: a betegek egyszerű kifejezésekkel kezdenek beszélni, majd csak egyes szavakat használnak, és egyáltalán nem beszélnek.
Az SLK második tünetegyüttese az epilepsziás rohamok. Jellemzőek a fokális motoros rohamok (pharyngooralis és hemifacialis), valamint az atipikus absanciás rohamok. Ritkábban fordulnak elő az atóniás, myoklonusos és generalizált görcsös paroxizmusok. A legtöbb esetben a rohamok ritkák; alvás és ébredés során figyelhető meg. A betegek 1/4-énél hiányoznak az epilepsziás rohamok. Ezekben az esetekben a diagnózist szerzett afázia, súlyos kognitív károsodás előfordulása és EEG-adatok alapján állapítják meg.
A neurológiai állapotban nincsenek gócos tünetek. A pszichológiai vizsgálat szenzoros vagy teljes afáziát, gyakorlati zavarokat tár fel. viselkedési zavarok jellemzőek.
Az EEG az esetek 100%-ában meghatározza az epileptiform rendellenességek jelenlétét. Tipikus nagy amplitúdójú (200-400 μV) regionális éles hullámok vagy éles-lassú hullám komplexek, lokalizált
fürdőszobák főleg a posterior temporális vagy parietotemporális területeken. Az epileptiform aktivitás alvás közben (a REM és nem REM alvás fázisában egyaránt) növekszik, diffúzan terjed, általában megtartva a beszéd domináns féltekéjének amplitúdó-dominanciáját. Az alvásrögzítés bizonyos korszakaiban az epileptiform aktivitás indexe elérheti a 100%-ot. Az epileptiform tevékenység súlyos beszédzavarok kialakulásához vezet (a kognitív epileptiform szétesés megnyilvánulása). Az MRI általában normális.
Az SLK kezelési rendje az epilepsziás rohamok jelenlététől vagy hiányától függ. Az epilepsziás rohamok nélküli SLK esetében a szukcinimidekkel vagy benzodiazepinekkel végzett monoterápia hatásos. A kezdeti kezelés szukcinimidekkel történik. Az etosuximidet 500-1000 mg/nap (25-35 mg/ttkg/nap) dózisban írják fel 3 részre osztva. A második választandó gyógyszer a klobazám 10-30 mg/nap (0,5-1,0 mg/kg/nap) dózisban, 2-3 adagban. Ezek a gyógyszerek blokkolják a folyamatos diffúz epileptiform aktivitást az EEG-n, ami a beszédfunkciók helyreállításához vezet. Epilepsziás rohamok esetén csak kiegészítő AED-ként használják őket.
Epilepsziás rohamokkal járó SLK esetén a kezelés valproinsavval kezdődik, 900-2000 mg / nap (30-70 mg / kg / nap) dózisban, 2 részre osztva. A választott gyógyszer a topiramát. A Topamaxot az adag fokozatos emelésével 50-150 mg / napra (3-7 mg / kg / nap) 2 részre osztva írják fel. Ha a monoterápia sikertelen, mérlegelni kell a kombinált kezelést. Optimális kombinációk SLK-hoz: valproátok + szukcinimidek, valproátok + topiramát, valproátok + benzodiazepinek. A terápia hatékonyságának egyik legfontosabb kritériuma a másodlagos kétoldali szinkronizáció jelenségének blokkolása az EEG-n (diffúz kisülések).
A karbamazepin alkalmazása ellenjavallt a rohamok lehetséges növekedése, a megnövekedett másodlagos kétoldali szinkronizáció az EEG-n és a beszédzavarok elmélyülése miatt.
A kortikoszteroidok (synacthen-depot, dexametazon) tartalék gyógyszerek. Pozitív hatással vannak a beszéd helyreállítására. Lehetséges pulzusterápia dexametazonnal 1 mg/ttkg/nap dózisban. A módszer a gyógyszer 2 hetente történő felírásából áll; akkor a dexametazon alkalmazása nélküli intervallum 4-8 hét, majd ismét egy 2 hetes kúra. Ebben az esetben az AEP alapterápiáját megszakítás nélkül végzik.
A subpialis bemetszéseket az SLK sebészeti kezelésére használják.
ElőrejelzésSLX-szel az epilepsziás rohamok szempontjából kedvező: a betegek 100%-ában a rohamok teljesen megszűnnek a pubertás időszakára (AED hatására vagy spontán). Terápia hiányában vagy nem megfelelő kezelés esetén (esetleg a betegség fel nem ismert epilepsziás jellege miatt) a beszéd- és kognitív károsodások fennmaradhatnak.
Epilepszia elektromos állapot epileptikussal lassú alvásban (szinonimák: epilepszia folyamatos csúcs-hullám aktivitással az EEG-n lassú alvás közben, ESES-szindróma - elektromos állapot epilepticus lassú alvás közben) az 1989-es osztályozás szerint olyan formákra utal, amelyek általános és részleges jellemzőkkel is rendelkeznek. A szindróma patogenezise a kérgi központok folyamatos epileptiform aktivitásának állandó "bombázásával" függ össze funkcionális gátlásuk kialakulásával és a neuronális kapcsolatok megszakadásával, ami súlyos kognitív károsodás kialakulásához vezet.
A fokális és pszeudogeneralizált epilepsziás rohamok jelenléte súlyos kognitív károsodással és a nem-REM alvás alatti folyamatos diffúz epileptiform aktivitás mintázatával kombinálva, amely folyamatosan több hónapig és évig tart, patognomonikus.
Jelölje ki a szindróma idiopátiás és tüneti változatait. A tüneti változatban pszichomotoros retardáció, fokális neurológiai tünetek (strabismus, agyi bénulás hemiparetikus formája, ataxia), a neuroimaging során fellépő szerkezeti változások a rohamok megjelenése előtt jelen vannak. A "klasszikus" (idiopátiás) változatnál ezek a jelek hiányoznak. Az epilepsziás rohamok kezdeti kora Tassinari (2002) szerint 8 hónaptól 12 évig terjed, átlagosan 4,7 év. A betegek között túlsúlyban vannak a fiúk. A betegek legalább 1/3-ának nincs epilepsziás rohama. Ebben az esetben a diagnózist a folyamatos, folyamatos epileptiform aktivitás kombinációja alapján állítják fel lassú alvás súlyos kognitív károsodással.
A betegség kezdete jellemző fokális motoros (pharyngooralis, hemifacialis, unilaterális) görcsrohamokkal vagy váltakozó hemiconvulsiókkal, elsősorban
alvási idő (különösen ébredés előtt). Az esetek 15%-ában lázgörcsöket jegyeztek fel. A rohamok általában ritkák; bizonyos esetekben - egyetlen. Ebben a szakaszban még nincsenek kifejezett kognitív károsodások. A betegség ezen időszakában a diagnózis nem állapítható meg.
A második időszak (részletes klinikai megnyilvánulások) néhány hónappal vagy évvel az első rohamok megjelenése után következik be. Klinikailag "pszeudogeneralizált" rohamok megjelenése és mindenekelőtt atipikus hiányzások jellemzik, általában atonikus komponenssel ("bólintások", a törzs előrehajlítása, a lábak hajlítása). Ezenkívül myoklonus rohamok, esések rohamai és generalizált tónusos-klónusos rohamok lehetségesek. A legtöbb ilyen roham az EEG másodlagos kétoldali szinkronizációjának a jelensége. A jelenség megjelenésével a kognitív károsodások észrevehetővé válnak, és gyorsan növekednek. A kognitív funkciók (memória, figyelem, reakciósebesség, parancsok végrehajtása stb.) zavarát, amely káros a szociális alkalmazkodásra és tanulási képtelenségre, „a gyermekek epileptiform kognitív szétesésének” nevezik. Viselkedési változások (pszichopátiás, skizofrén, autista-szerű szindrómák). A beszédzavarok közé tartozik a szenzoros vagy motoros afázia, az orolingo-buccomotoros diszpraxia és a hallási agnosia. Állandó hemiparesis vagy ataxia van (amikor az epilepsziás fókusz főleg a motoros kéregben található). Ritka tünetek közé tartozik az alexia, acalculia. A legtöbb esetben a jogsértések minden fajtája bizonyos fokig kombinálódik. Az „álgeneralizált” rohamok és a magasabb mentális funkciók megsértésének klinikai megjelenése korrelál az EEG-n a folyamatos epileptiform aktivitás megjelenésével nem REM alvásban.
A harmadik, utolsó szakaszban a rohamok gyakorisága fokozatosan csökken; megritkulnak, egyedülállóvá válnak, érzékenyebbek a terápiára. Ebben az esetben a magasabb mentális és motoros funkciók fokozatos, folyamatos javulása következik be (általában a pubertás kezdetével).
Az EEG döntő szerepet játszik az EESM diagnózisában. Talán az epileptiform aktivitás hiánya ébrenlét alatt. Jellemző a diffúz epileptiform aktivitás megjelenése és erőteljes növekedése nem REM alvás során, legmagasabb indexével, amely ebben a fázisban eléri a 85-100%-ot. Ez a tevékenység
hónapokig és évekig folytatódik. Az alvás élettani mintái eltűnnek. A REM alvás során az epileptiform aktivitás csökken vagy blokkolódik.
A neuroimaging módszerek a legtöbb esetben nem tárnak fel jogsértéseket. Tüneti változatok esetén helyi rendellenességek figyelhetők meg, amelyek perinatális károsodás, agyi dysgenesis eredményeként jelentkeznek.
A kezelés taktikája az EECM-szindróma esetén az epilepsziás rohamok jelenlététől vagy hiányától függ. Epilepsziás rohamok nélküli nem REM alvás elektromos epilepsziás állapotában a szukcinimidekkel vagy benzodiazepinekkel végzett monoterápia hatásos. Az etosuximidet 500-1000 mg/nap (25-35 mg/ttkg/nap) dózisban írják fel 3 részre osztva. A választott gyógyszer a benzodiazepinek. A klobazamot 10-30 mg/nap (0,5-1,0 mg/ttkg/nap) dózisban, 2-3 adagban alkalmazzák. Ezek a gyógyszerek élesen blokkolják a folyamatos diffúz epileptiform aktivitást az EEG-n, és közvetve a kognitív funkciók javulásához vezetnek.
Epilepsziás rohamok esetén csak kiegészítő AED-ként alkalmazzák, és a kezdeti terápiát valproinsav-készítményekkel, majd monoterápiaként topiramáttal végzik. A valproátokat 600-2000 mg/nap (30-70 mg/ttkg/nap) dózisban írják fel 2 részre osztva. A második választott gyógyszert - a topiramátot - az adag fokozatos emelésével 50-150 mg / napra (3-7 mg / kg / nap) 2 részre osztva írják fel.
A monoterápia elégtelen hatékonyságával kombinált kezelést alkalmaznak. Optimális kombinációk: valproátok + szukcinimidek, valproátok + topiramát, valproátok + benzodiazepinek (klobazám). A kezelés hatékonyságának legfontosabb kritériuma az index csökkenése vagy a folyamatos epileptiform aktivitás teljes blokkolása az EEG-n. A karbamazepin alkalmazása ellenjavallt a görcsrohamok előfordulásának vagy növekedésének lehetősége, valamint az EEG-n megnövekedett másodlagos kétoldali szinkronizáció és a kognitív károsodás elmélyülése miatt.
Rezisztens esetekben kortikoszteroidokat (sinacten-depot, prednizolon, metipred, dexametazon stb.) kell hozzáadni az alapvető AED-ekhez. A Sinakten-depot napi 0,1 mg-tól kezdődően írják fel, fokozatosan 0,1 mg-mal 3-5 naponként 1,0 mg-ra emelve. A kezelés időtartama 3-4 héttől több hónapig terjed, fokozatos megvonás mellett. Ugyanakkor az AEP alapterápiája
megszakítás nélkül végrehajtani. A hormonok kifejezett blokkoló hatással bírnak az EEG epileptiform aktivitására, és hozzájárulnak a beszédfunkciók javításához.
Tüneti jelleg esetén sebészeti kezelés lehetséges - kortikális reszekció. Például hemimegalencephaliában a súlyos, visszafordíthatatlan kognitív dezintegráció elkerülésének egyetlen módja a funkcionális hemisferotomia.
Az epilepsziás rohamok prognózisa kedvező, a kognitív károsodások pedig súlyosak. A görcsrohamok jól reagálnak a megfelelő AED-kezelésre, és általában 10-12 év múlva eltűnnek. A nem REM alvás alatti folyamatos epileptiform aktivitás fokozatos megszűnésével a kognitív funkciók is javulnak a pubertás beálltával. A betegek fele azonban kifejezett intellektuális-mnesztikus hibával "jön ki" a betegségből, és nem tud általános iskolában tanulni.
specifikus szindrómák. A gyermekneurológia specifikus szindrómái közül különösen fontosak a lázgörcsök és a status epilepticus.
14.5. Lázas görcsök
Lázas görcsök (FS) - görcsök 6 hónapos és 5 éves kor közötti gyermekeknél, amelyek olyan hőmérsékleten fordulnak elő, amely nem jár neurofertőzéssel. Az agyhártyagyulladás, encephalitis akut stádiumában lévő gyermekek görcsrohamai nem tartoznak az FS kategóriájába, hanem az idegfertőzés tüneti megnyilvánulásainak tekintendők. FS a gyermekek 5%-ában fordul elő. Az FS a görcsös készenlét küszöbének genetikailag meghatározott csökkenésén alapul, hipertermia során generalizált görcsös váladékok előfordulásával. Az öröklődés poligénikus; a FEB1 lókusz (8ql3-q21 kromoszóma) és az 5ql4ql5 kromoszóma FEB4 hibáira gyanakszanak. A gyermekeknél a FS kialakulásának valószínűsége meglehetősen magas lehet - 5-20%.
Vannak tipikus (egyszerű) és atipikus (összetett) FS. A tipikus FS genetikailag meghatározott, neurológiailag egészséges gyermekekben fordul elő, és az összes FS eset akár 90%-át teszik ki. Általános tónusos-klónusos rohamokban nyilvánul meg a magas láz hátterében. Az FS általában a láz első napján jelentkezik, általában akkor, amikor a gyermek elalszik. Időtartam
a rohamok nem haladják meg a 10 percet, a prolapsus támadás utáni tünetei hiányoznak. Az interiktális időszakban az EEG a normál tartományon belül volt. A gyermekek több mint 50%-ának FS visszatérő. A tipikus FS nem befolyásolja a gyermek fejlődését, és 5 év után kezelés nélkül teljesen elmúlik. Az epilepsziába (főleg idiopátiás formákba) való átalakulás kockázata nem több, mint 10%.
Az atipikus FS (komplex) az összes FS eset körülbelül 10%-át teszi ki. A következő tulajdonságok jellemzik őket
A bemutatkozás kora 1 év előtt vagy 5 év után.
A rohamok hosszú időtartama - több mint 30 perc.
Az első roham állapot epilepticussal jelentkezhet, amely újraélesztést igényel.
Fokális komponensű rohamok: a fej és a szemek elfordulása, hemiconvulsiók, "ernyedtség".
Prolapsus tüneteinek előfordulása roham után (pl. Todd-bénulás, afázia).
Fokális neurológiai tüneteket és kognitív károsodást azonosítanak.
Regionális lassulás az EEG-n az egyik időbeli elvezetésben.
Az MRI-n az atipikus FS félelmetes jelét állapítják meg - a mesialis temporális szklerózist (az éretlen agyra rárakódó, elhúzódó FS-sel járó ischaemiás stroke eredménye).
Az atipikus FS rossz prognózisú. Gyakran kapcsolódnak kognitív károsodáshoz. Az epilepsziába való átalakulás kockázata körülbelül 15%; mesialis temporalis sclerosis jelenlétében erősen megemelkedik. A hosszan tartó, nem kontrollált atipikus FS ischaemiás típusú akut cerebrovascularis baleset kialakulásához és tartós motoros deficit megjelenéséhez vezethet. Ebben az esetben egy FS-epizód után hemiparesis és rezisztens epilepszia alakul ki félkonvulzív rohamokkal: HHE-szindróma (epilepszia hemiconvulsióval és hemiplegiával).
A tipikus FS-ben szenvedő betegeknek nincs szükségük hosszú távú terápiára és gyógyszeres profilaxisra. Fizikai hűtés javasolt hipertermia esetén (szellőztetés, alkohollal, ecettel való bedörzsölés), lítikus keverékek bevezetése. Ismételt FS esetén javasolt megtanítani a szülőket, hogy a roham idején 0,5-1,5 ml-es adagban adják be a diazepam készítményeket intramuszkulárisan. Ez azért történik, hogy megakadályozzák az elhúzódó roham és a status epilepticus kialakulását. Terápia
AEP nem kerül végrehajtásra. Egyes esetekben benzodiazepinek vagy fenobarbitál profilaktikus beadása lehetséges terápiás dózisban a láz időtartamára (3-5 nap). Az ilyen "megelőzés" hatékonysága azonban nem bizonyított.
Az atipikus FS diagnózisa esetén éppen ellenkezőleg, kezelést kell előírni, mint az epilepszia esetében (például karbamazepin gyógyszerek vagy valproát életkor szerinti dózisokban). Az atípusos FS súlyos, hosszan tartó rohama esetén ugyanazokat az intézkedéseket kell megtenni, mint status epilepticus esetén.
Megkülönböztető diagnózis Az epilepsziát ájulás, pszichogén rendellenességek, alvászavarok, nem epilepsziás myoclonus, migrén, hyperkinesis kísérik. A klinikai gyakorlatban a legnagyobb nehézséget a syncope és a konverziós (pszichogén) rohamokkal járó epilepszia differenciáldiagnózisa jelenti.
14.6. Az epilepszia kezelésének általános alapelvei
Az alapelv: maximális terápiás hatékonyság minimális mellékhatással. Az epilepsziában szenvedő betegek évekig kénytelenek AED-t használni. Ebben a tekintetben a folyamatos terápia fontos követelménye, hogy a gyógyszerek ne gyakoroljanak negatív hatást a betegek életminőségére.
A betegnek meg kell felelnie az alvásnak és az ébrenlétnek; kerülje az alvásmegvonást, a késői lefekvést és a korai (különösen a hirtelen) ébredést. A serdülőknek és a felnőtteknek azt tanácsolják, hogy tartózkodjanak az alkoholfogyasztástól. Súlyos fényérzékenységgel járó epilepsziás formákban kerülni kell a ritmikus fénystimulációt. E szabályok szigorú betartása csökkentheti az epilepsziás rohamok gyakoriságát a betegek 20%-ában.
Az epilepszia kezelése csak pontos diagnózis felállítása után kezdhető meg. Az epilepszia megelőző kezelése elfogadhatatlan! Az EEG változása a betegség tünetének hiányában nem indokolja a terápia felírását. Kivételt képez a súlyos traumás agysérülés (agyi zúzódás, vérömleny), amely után 6-12 hónapos időtartamra lehet alap AED-t felírni. Epilepsziás encephalopathiák esetén a kezelés a magasabb mentális funkciók súlyos károsodásával járó diffúz epileptiform aktivitás kombinációja alapján írható elő rohamok hiányában.
Az epilepszia kezelését egy második roham után kell elkezdeni. Egyetlen roham lehet „véletlen”, láz, anyagcserezavarok miatt, és nem kapcsolódik az epilepsziához. Az AED-t csak ismételt provokálatlan epilepsziás rohamok esetén írják fel. Néhány jóindulatú gyermekkori epilepsziás szindrómában (elsősorban RE) és az epilepszia reflexes formáiban (olvasási epilepszia, primer fényérzékenységi epilepszia) a betegek AED nélkül is kezelhetők, ha a rohamok nagyon ritkák és a megelőző intézkedések során könnyen előfordulnak.
Az AED felírásakor fontos figyelembe venni a monoterápia elvét: a kezdeti kezelést egy gyógyszerrel végzik. A monoterápia elkerüli a súlyos mellékhatások és teratogén hatások előfordulását, amelyek gyakorisága több gyógyszer egyidejű kinevezésével jelentősen megnő. Kivételt képeznek az epilepszia rezisztens formái (West-szindróma, Lennox-Gastaut-szindróma, tüneti fokális epilepszia), amelyeknél lehetetlen hatást elérni kombinált terápia alkalmazása nélkül. A gyógyszereket szigorúan az epilepszia formájának és a rohamok természetének megfelelően írják fel. Az epilepszia kezelésének sikerét nagymértékben meghatározza a szindróma diagnózisának pontossága.
Első alkalommal a gyógyszert alacsony dózissal kezdve írják fel, fokozatosan növelve a terápiás hatás eléréséig vagy a mellékhatások első jeleinek megjelenéséig. Ez a gyógyszer hatékonyságát és tolerálhatóságát veszi figyelembe, nem pedig a vérben való tartalmát. A kezdő adag általában a becsült átlagos terápiás érték 1/8-1/4-e. Az adag növelése 5-7 naponként történik (a gyógyszer tolerálhatóságától és az epilepszia lefolyásának jellemzőitől függően).
Az AED-t megfelelő korú dózisokban kell felírni. Az alacsony dózisok alkalmazása a klinikai gyakorlatban az „álrezisztencia” egyik fő oka. Nem szabad megfeledkezni arról, hogy az epilepszia súlyos formáiban az egyetlen esély, hogy valóban segítsen a betegen, az AED nagy dózisú felírása (24. táblázat).
Ha a gyógyszer hatástalan, fokozatosan helyettesítik egy másikkal, amely potenciálisan hatékony az epilepszia ezen formája esetén. Nem lehet azonnal hozzáadni egy második gyógyszert, azaz átváltani a politerápiára.
Körülbelül 30 AED létezik, amelyek különböző antiepileptikus hatásspektrummal és mellékhatásokkal rendelkeznek. Előnyben részesítik a modern AED-ket, amelyek klinikai hatékonysága széles skálával rendelkezik, és jól tolerálhatók (valproátok, topiramát). A kezelés hosszan tartó, napi 2 alkalommal felírt készítményekkel javasolt (convulex retard, depakine-chrono, finlepsin retard, tegretol CR). Az alapvető AED-k közé tartoznak a valproátok (depakin, convulex, convulsofin) és a karbamazepin (finlepsin, tegretol, trileptal). A szukcinimideket (suxilep), a benzodiazepineket (klonazepam, klobazám) és a lamotrigint (lamiktál) gyermekeknél kiegészítő terápiaként alkalmazzák. Az új AED-ket (topiramát, levetiracetám, oxkarbazepin) monoterápiaként és alap AED-ekkel kombinálva írják fel. A régi AED-k közé tartoznak a barbiturátok (fenobarbitál, hexamidin, benzonál) és a hidantoinok (difenin, fenitoin); súlyos mellékhatásaik vannak, és az utóbbi időben egyre kevesebbet írnak fel.
A terápia és a mellékhatások ellenőrzése érdekében ezt 3 havonta egyszer kell elvégezni. klinikai elemzés vér a vérlemezkék szintjének kötelező vizsgálatával, valamint biokémiai vérvizsgálattal a bilirubin, koleszterin, májenzimek tartalmának meghatározásával. 6 havonta egyszer elvégzik a hasi szervek ultrahangját. Ezenkívül minden vizsgálat alkalmával ajánlott ellenőrizni az antiepileptikumok szintjét a vérben. A beteg vagy szülei köteles naplót vezetni.
24. táblázatAz AED kinevezéséből adódó hatás elmaradásának okai

Rezisztens esetekben műtéti reszekció, vagus ideg stimuláció és ketogén diéta javasolt. A sebészeti kezelés indikációit szigorúan be kell tartani, a betegeket műtét előtti vizsgálatnak kell alávetni, amely csak speciális központokban lehetséges. Az AED-re rezisztens epilepszia tüneti fokális formáiban a sebészeti kezelés lehet az egyetlen módja annak, hogy a betegeket teljesen megmentsék a rohamoktól.
Tartós remisszió - 1 évig vagy tovább nincs roham. A rohamok és az EEG normalizálása hiányában teljes remisszióról beszélünk.
Az AED csökkentésének és megszüntetésének feltételei szigorúan egyéniek, és elsősorban az epilepszia formájától és a betegség lefolyásának jellemzőitől függenek. Az idiopátiás gócos formákban és a gyermekkori hiányepilepsziában az AEP csökkenése 3 év rohammentes év után kezdődhet; tünetekkel járó fokális epilepsziával, az idiopátiás generalizált epilepszia juvenilis változataival - legkorábban 4 év remisszió után. Az AED teljes eltörlése fokozatosan, általában 1 éven belül történik.
Kedvezőtlen prognózistényezők: koraszülöttség anamnézisben, rohamok korai megjelenése, status epilepticus, fokális neurológiai rendellenességek, csökkent intelligencia, súlyos viselkedési zavarok, folyamatos regionális lassulás jelenléte vagy másodlagos kétoldali szinkronizáció jelensége az EEG-n, szerkezeti változások a neuroimaging során, hiány az alapvető antiepileptikumok megfelelő dózisban történő alkalmazásának hatása. Jelenleg az AED-k teljes arzenáljának használatának köszönhetően a betegek 65% -a képes elérni a rohamok stabil remisszióját.
14.7. Epilepsziás állapot
Epilepsziás állapot (ES) 30 percnél tovább tartó roham vagy ismétlődő, gyakori roham, amely között a tudat nem áll vissza teljesen. Az SE kialakulásával fenyegetett állapotok: elhúzódó (5 percnél hosszabb) roham vagy 3-nál több generalizált görcsroham, amely 24 órán belül jelentkezett.
Az ES átlagos előfordulási gyakorisága 28 eset/100 000 az általános népességben és 41/100 000 gyermek. Az epilepsziás felnőtt betegek 5%-ánál és a gyermekek 20%-ánál fordult elő ES. Az esetek 26%-ában 1 évesnél idősebb gyermekeknél fordul elő ES, az esetek 43%-ában -
az első 2 évben, és az első 3 évben - 54%. Az SE a sürgősségi neurológiában előforduló esetek 4%-át teszi ki. A mortalitás ES-ben speciális ellátás hiányában akár 50%, megfelelő kezelés mellett pedig 5-12%.
Az epilepszia lefolyásának romlása, az antiepileptikumok nem megfelelő alkalmazása, fertőző betegségek lázzal. Az ES bonyolítja a TBI-t, hematómát, stroke-ot, neuroinfekciókat, exogén mérgezéseket, súlyos anyagcserezavarokat stb.
Az ES patogenezise 2 fázisból áll.
1. A rohamok folyamatos aktivitása felgyorsítja az agy anyagcseréjét, válaszul a megnövekedett agyi véráramlásra, valamint az oxigén és glükóz áramlására. Fokozatosan a kompenzációs mechanizmusok kimerülnek, acidózis alakul ki, és megemelkedik a laktátszint az agyszövetekben. Ez a szívműködés megsértéséhez vezet: emelkedik a vérnyomás, a perctérfogat és a pulzusszám. A szimpatikus rendszer aktivitásának növekedése fokozott nyálfolyást, izzadást, a hörgők szekréciójának növekedését és a hyperpyrexiát okozza. Hiperglikémia van az adrenalin és a noradrenalin felszabadulásának növekedése miatt.
2. A kompenzációs mechanizmusok megzavarása ödéma kialakulásához és az idegsejtek degenerációjához, az epileptogenezis további erősödéséhez vezet. Az agyi véráramlás a szisztémás artériás nyomástól kezd függni. A hipotenziót súlyosbítja a hipoxia, egyes esetekben gyógyszereket(például a Relanium intravénás beadása). Agyödéma alakul ki, az agyi véráramlás csökken. Mindezen változások eredményeként agyi ischaemia, hipoxia és acidózis alakul ki. Később több szervi elégtelenség is csatlakozik: szisztémás acidózis, hipoglikémia, májműködési zavar, veseelégtelenség, rhabdomyolysis, DIC. Az intenzív terápia szövődményei lehetségesek: fertőzések, tüdőembólia, elektrolit-egyensúlyzavar.
Az ES kiosztása során:
Pre-státusz (0-9 perc a rohamok kezdete óta);
Kezdeti (10-30 perc);
Kiterjesztett (31-60 perc);
Tűzálló (60 perc felett).
Görcsös ESolyan állapot, amelyben a tartós vagy időszakos tónusos-klónusos görcsök több mint 30 percig fennállnak anélkül, hogy a rohamok között helyreállna az eszmélet. A görcsös ES az összes ES eset 10-25%-át teszi ki. Kezdetben a támadások gyakoribbá vagy elhúzódóvá válnak (egy ES által fenyegetett állapot kialakulásával). Ebben az időszakban az ES kialakulása megelőzhető. A tipikus tónusos-klónusos görcsök idővel gyakoribbá válnak, teljes eszméletvesztés következik be. Kóma állapotában a klón aktivitás csökkenhet - szinte a teljes eltűnésig. Ilyenkor fokozódnak a légzési, keringési és anyagcserezavarok. Az EEG-n görcsös SE során generalizált epileptiform aktivitás figyelhető meg éles hullámok, tüskék, gyors tüske-hullám komplexek formájában, amelyet lassulás követ. A bioelektromos aktivitást számos myográfiai és motoros műtermék takarja el. Az ES második szakaszában a fő tevékenység lelassul és ellaposodik. A "periodikus laterális epileptiform rendellenességek" és a háromfázisú hullámok megjelenése ES hosszú időtartama alatt figyelhető meg, és ez a kedvezőtlen prognózis (halálos kimenetel vagy vegetatív állapot kialakulása) markere. A görcsös ES mortalitása 5-19%, és az etiológiától függ. A neurológiai és mentális zavarok arányosak a státusz időtartamával.
Az ES speciális formája gyermekeknél az hemikonvulzív-hemiplegiás epilepsziás szindróma. Az első 4 életévben, gyakrabban lázban szenvedő gyermekeknél fordul elő, és a generalizált görcsös rohamok súlyos, elhúzódó állapota jellemzi, határozott egyoldalú akcentussal. A státusz lejárta után a beteg elhúzódó hemiplegiában szenved, amely a rohamok túlsúlyának oldalán jelentkezik. A legtöbb esetben a prognózis rossz – a jövőben a gyermekek 85%-ánál alakul ki kezelésre rezisztens tüneti fokális epilepszia intellektuális-mnesztikus zavarokkal és motoros deficittel.
ES Kozhevnikov epilepsziában állandó myoklonus rohamokban nyilvánul meg, amelyek a test egy bizonyos szegmensére korlátozódnak. Időnként motoros Jackson-féle rohamok fordulhatnak elő másodlagos generalizációval.
A myoklonusos rohamok ES kontrollálatlan gyakori, szinte folyamatos myoclonusban nyilvánul meg, amely a distalis végtagokban kifejezettebb, és kíséri
kábulat, nem teljes eszméletvesztés. A myoclonus status epilepticus alattomosan fejlődik, fokozatosan alakul ki, és több napig, hónapig, sőt évekig is eltarthat, progresszív demencia kíséretében. Az EEG mioklónusos státuszban általában többszörös multispike-wave kisüléseket mutat fiziológiás háttéraktivitás hiányában, valamint diffúz folyamatos lassulást többszörös multifokális tüskékkel és diffúz és generalizált tüske- és polispike-hullám komplexekkel.
Nem görcsös ES (absence status) rendszeres generalizált csúcshullám-aktivitás megjelenése jellemzi az EEG-n. A gyermekkori távollét legjellemzőbb típusa a tipikus hiányzások ES (csúcshullámú stupor). Leggyakrabban gyermekkori és ifjúkori absszív epilepszia, ritkábban juvenilis myoclonus epilepszia keretében figyelhető meg. A hiányzások meredek növekedésében nyilvánul meg, egymás után közvetlenül vagy nagyon rövid időközönként. Amimia, nyálfolyás, kábulat lép fel. A gyermek álmodozónak tűnik, mozgása lassú. A tudatzavar mértéke változó. A gyerekek néha megőrzik azt a képességet, hogy válaszoljanak a hívásra és egyszerű feladatokat hajtsanak végre. Meghatározható az arc, váll, kar izmainak myoclonusa. Állapot időtartama - néhány perctől több óráig, sőt napokig. A hiányzás állapota gyakran reggel, közvetlenül a betegek felébresztése után következik be, és gyakran generalizált görcsrohamokkal végződik. A betegek felénél a státusz kiújul a nem megfelelő kezelés mellett. A hiányállapotot az alváshiány vagy a nem megfelelő kezelés, különösen a karbamazepin és vigabatrin alkalmazása váltja ki.
Komplex fokális rohamok ES klinikailag változó. Általában több órától több napig tartó zavart időszakkal kezdődik. A szemek tágra nyíltak, az arc hipomikus. Hosszú távú ambuláns automatizmusok figyelhetők meg, amelyek külsőleg céltudatos, céltudatos és összehangolt mozgásokra emlékeztetnek, általában interakcióval. Ebben az állapotban a betegek céltalanul bolyonghatnak az utcákon; beszállni a közlekedésbe, indulni más városokba. A tudat gyakran nincs teljesen kikapcsolva, és a beteggel részleges kapcsolat is megmaradhat. Lehetséges hajlamosító tényezők közé tartozik az alkoholfogyasztás, a kábítószer-függőség, a fertőzések, a menstruáció, az elektromosság
erysipelas terápia. Az EEG-n állandó vagy periodikus, regionális (gyakrabban az időbeli elvezetésekben) paroxizmális aktivitás figyelhető meg csúcshullám komplexek, izolált csúcsok vagy lassú csúcshullám aktivitás formájában.
Status epilepticus kezelése. A kezdeti szakaszban tanácsos gyorsan ható gyógyszereket használni, a későbbi szakaszokban pedig olyan gyógyszereket, amelyek nem halmozódnak fel a szervezetben, és minimális mellékhatásokkal rendelkeznek. Az ES terápiás intézkedései szigorúan megkülönböztetik az ES stádiumától függően: az 1. szakaszban a terápiás intézkedéseket a prehospitális szakasz; a 2. és 3.-ban - a neurológiai osztály intenzív osztályának körülményei között, a 4.-ben - az intenzív osztályon. A 2. szakaszban minden diagnosztikai intézkedést el kell végezni az ES etiológiájának azonosítására és az életjelek monitorozására.
I. Pre-státusz (0-9 perc a rohamok kezdetétől) - időben megkezdett megfelelő kezeléssel megelőzhető a súlyos ES kialakulása:
A légutak átjárhatóságának biztosítása;
oxigénterápia;
Diazepam (2 ml-ben 10 mg) IV 0,25 mg/kg, beadási sebesség - 2-4 mg/perc. 30 percenként megismételhető. A gyógyszer teljes napi adagja nem haladhatja meg a 40 mg-ot. A fő mellékhatás a légzésdepresszió.
II. Korai állapot (10-30 perc):
folytassa a diazepamot;
Lorazepam (1 ml-ben 4 mg) 0,05-0,1 mg/kg, 2 mg/perc sebességgel. 1 vagy 2 alkalommal adják be 20 perces időközönként, összesen legfeljebb 4 mg-ot. Mellékhatások: tolerancia kialakulása 1-2 injekció után; ritkán - légzésdepresszió (kevésbé kifejezett, mint a diazepammal), artériás hipotenzió;
Fenitoin (difantoin) (5 ml-ben 250 mg) IV, sóoldattal hígítva 5-20 mg/ml. Adagolás - 15-20 mg / kg 25 mg / perc sebességgel. Lehetőség van a gyógyszer ismételt beadására 6 óránként 5 mg/ttkg dózisban IV vagy orálisan, csövön keresztül. A fenitoin koncentrációját a vérben 20-25 mcg / ml szinten kell tartani.
Mellékhatások: szívmegállás, artériás hipotenzió, phlebosclerosis. Fenitoin hiányában lehetséges a nátrium-oxibutirát (GHB) intravénás beadása (1 ml 200 mg-os 20%-os oldatban). Adagolás - 100-150 mg / kg 400 mg / perc sebességgel. Mellékhatás- hipokalémia.
III. Kibontott állapot (31-60 perc):
diazepam vagy lorazepam;
Fenobarbitál (1 ml-ben 200 mg) IV. Adagolás 1 évesnél fiatalabb gyermekek számára - 20 mg / kg, majd - 15 mg / kg, legfeljebb 100 mg / perc sebességgel. Az egyszeri adag nem haladhatja meg a maximális életkort, és nem haladhatja meg az 1000 mg-ot. A gyógyszer 8 óránként 3-5 mg / kg / nap dózisban szájon át, csövön keresztül beadható. Mellékhatások: a szívizom kontraktilitásának csökkenése, légzésdepresszió, tudatzavar, artériás hipotenzió;
Alternatív megoldás a depakin intravénás beadása intravénás injekciók 20-25 mg / kg dózisban az első 5-10 percben, majd - 2 mg / kg / óra. A standard adag 25 mg/ttkg/nap. Az 5 mg-os fenntartó adagot naponta négyszer adják be, vagy állandó infúziót hajtanak végre 1 mg / kg / óra dózisban. Az intravénás beadásra szánt Depakine nem csökkenti a légzést és a szívműködést; a vérplazmában a szükséges koncentráció gyorsan elérhető; elkerüli a beteg intubálását; nagyon hatékony (80-90%), beleértve a diazepam és a fenitoin hatástalanságát; garantálja, hogy a rohamok 24 órán belül nem ismétlődnek.
IV. A refrakter állapot (60 perc felett) súlyos, gyakran visszafordíthatatlan elváltozásokkal jár az agyban és belső szervek, anyagcserezavarok:
A beteg intubálása mesterséges tüdőlélegeztetéssel az intenzív osztályon;
Barbiturikus érzéstelenítés: nátrium-tiopentál (1 ml 2,5%-os 25 mg-os oldatban) intravénás beadása átlagosan 100-250 mg dózisban 20 másodpercig. Ha nincs hatás, a gyógyszer további adagolása 50 mg IV dózisban 3 percenként, amíg a rohamok teljesen enyhülnek. Ezenkívül a fenntartó dózisra való áttérés - átlagosan 3-5 mg / kg IV óránként (a gyógyszer vérszintjének folyamatos ellenőrzése szükséges). A gyógyszer összdózisa nem haladhatja meg az 1 g-ot A barbiturikus érzéstelenítés időtartama általában 12-24 óra Szövődmények: csökkent szívizom-összehúzódás, súlyos légzésdepresszió,
artériás hipotenzió, toxikus hepatitis és hasnyálmirigy-gyulladás, anafilaxiás sokk;
Az ES megszüntetése és a tudat helyreállítása után - átmenet a szükséges antiepileptikumok orális adagolására.
Az ES 2.-4. szakaszában további terápiát végeznek, amelynek célja az életfunkciók korrekciója, elektrolit zavarok, az agyödéma elleni küzdelem (dexametazon-nátriumsó 4 mg IV 6 óránként vagy mannit 1,0-1,5 g/kg IV csepegtetés 60-80 csepp/perc sebességgel).
Status epilepticus kezelésére 1 éves gyermekeknél alkalmaz:
benzodiazepinek
Diazepam (0,5 mg/kg per végbél, IM vagy IV),
Lorazepam (0,2 mg/kg per végbél vagy IV),
Midazolam (0,15-0,4 mg / kg IV bolus, fenntartó infúzió - 1-3 mcg / kg / perc);
Hidantoinok
Foszfenitoin (20 mg/kg IV),
Fenitoin (20 mg / kg IV, a maximális adagolási sebesség 25 mg / perc, plazmakoncentráció 20-25 μg / ml).
Tűzálló állapothoz alkalmaz:
nátrium-hidroxi-butirát (GHB) 100-150 mg/kg dózisban, 400 mg/perc sebességgel;
fenobarbitál (20 mg / kg IV, ismételt bólus 20-30 perc után, a maximális adag 100 mg / kg naponta);
Propofol (3 mg/kg IV bolus, majd 100 mcg/kg/perc infúzió).
400 mg depakin injekció 1 injekciós üvegben: kezdeti adag - 15-25 mg / kg, majd fenntartó infúzió - 1-4 mg / kg / óra.
Előrejelzés.Az ES következményei lehetnek: teljes gyógyulás, gyógyulás tartós rendellenességek jelenlétével, halál. Általában minél fiatalabb a gyermek, annál nagyobb a különböző szövődmények kialakulásának kockázata. Sok betegnél görcsös ES után a CT vagy MRI az agykéreg diffúz vagy lokális atrófiáját tárja fel. Alkalmazás előtt modern módszerek kezelés a huszadik század elején. a SE okozta halálozás 51% volt; század végén. -18%. A halálozás magasabb a stroke-hoz, agyvelőgyulladáshoz, traumás agysérüléshez és agydaganatokhoz kapcsolódó ES-ben. Halál rendkívül ritka ES-ben az idiopátiás generalizált epilepszia részeként (az esetek legfeljebb 1%-ában).
1. Karlov V.A. Convulsive status epilepticus: megoldott és megoldatlan // Neurológiai folyóirat. - 2000. - ? 3. - S. 4-8.
2. Litvinovich EF, Savchenko A. Yu., Pospolit A.V. A status epilepticus farmakoterápiájának modern vonatkozásai // Klinikai epileptológia. - 2007. - ? 1. - S. 28-32.
3. Mukhin K.Yu., Petrukhin A.S. Az epilepszia idiopátiás formái: szisztematika, diagnózis, terápia. - M.: Orvostudomány, 2000. -
319 p.
4. Petrukhin A.S. Gyermekkori epileptológia. - M.: Orvostudomány,
2000. - 623 p.
5. Aicardi J., Chevrie J.J. Epilepticus görcsroham csecsemőknél és gyermekeknél // Epilepsia. - 1970. - 1. évf. 11. - R. 187-197.
6. Aminoff M.J., Simon R.P. Status epilepticus: okok, klinikai jellemzők és következmények 98 betegnél // Am. J. Med. - 1980. - 1. évf. 69.-
R. 657-666.
7. Brown J.K., Hussain N.H. Status epilepticus 1: patogenezis // Dev. Med. Clin. Neurol. - 1991. - 1. évf. 33. - P. 3-17.
8. Cascino G.D., Hesdorffer D., Logroscino G., Hauser W.A. Nem lázas állapotú epilepticus morbiditása Rochesterben, Minnesotában, 1965-1984 //
epilepszia. - 1998. - Vol. 39/8. - P. 829-832.
9. Cockerel O.C., Walker S.M., Sander J.W., Shorvon S.D. komplex részleges
Status epilepticus: visszatérő probléma // J. Neurol. Idegsebészeti pszichiátria. -
1994. - 1. évf. 57.-P. 835-837.
10. DeLorenzo R.J., Garnett L.K., Towne A.R. et al. Status epilepticus összehasonlítása elhúzódó, 10-29 percig tartó rohamepizódokkal //
epilepszia. - 1999. - 1. évf. 40/2. - P. 164-169.
11. Philips S.A., Shanahan R.J. A status epilepticus etiológiája és mortalitása gyermekeknél // Arch Neurol. - 1989. - 1. évf. 46 - R. 74-76.
12. Sander J.W.A.S., Hart Y.M., Trevisol-Bittencourt P.S. Távollét állapota //
Ideggyógyászat. - 1990. - 1. évf. 40. - 1010. o.
13. Shorvon S.D. Status epilepticus: klinikai jellemzői és kezelése gyermekeknél és felnőtteknél. - Cambridge: Cambridge University Press, 1994.
14. Wasterlain C.G. és Treiman D.M. Status Epilepticus: mechanizmusok és kezelés. - London: The MIT Press, 2006.
15. Treiman D.M. Status epilepticus // In: Az epilepszia tankönyve. - Szerk. J. Laidlaw, A. Richens, D. Chadwick. - Edinburgh: Churchill-Livingstone,
1993. - P. 205-220.


